 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Роль осмоса в биологических процессах
|
|
Осмос имеет большое значение в жизнедеятельности человека, животных и растительных организмов. Как известно, все биологические ткани состоят из клеток, внутри которых находится жидкость (цитоплазма), представляющая собой раствор различных веществ в Н2О. Оболочка клетки полупроницаема и через нее достаточно свободно проходит вода.
Ионы электролитов и молекулы других веществ оболочка пропускает строго избирательно.
Снаружи клетки омываются межклеточной жидкостью, тоже представляющей собой водный раствор. Причем концентрация растворенных веществ внутри клеток больше, чем в межклеточной жидкости. Вследствие осмоса наблюдается переход растворителя из внешней среды в клетку, что вызывает ее частичное набухание или тургор. При этом клетка приобретает соответствующую упругость и эластичность. Тургор способствует сохранению определенной формы органов у животных организмов, стеблей и листьев у растений. В срезанных растениях в результате испарения воды объем меж- и внутриклеточной жидкости уменьшается, снижается осмотическое давление, упругость клеток понижается и растение вянет. Увлажнение растений, помещение их в воду вызывает осмос и снова сообщает тканям упругость.
Кровь, лимфа, тканевые жидкости человека представляют собой водные растворы молекул и ионов многих веществ и обладают вследствие этого определенным осмотическим давлением. Причем на протяжении всей жизни организма биологические жидкости сохраняют свое давление на постоянном уровне, независимо от состояния внешней среды. Это явление называется иначе изоосмией человеческого организма и является составной частью более общего процесса – гомеостаза или постоянства ряда физико-химических показателей внутренней среды человека в изменяющихся внешних условиях.
Изоосмия особенно присуща таким биологическим жидкостям, как кровь и лимфа. Так, осмотическое давление крови у человека практически постоянно, и при 37оС изменяется в пределах 740-780 кПа (т.е., почти в 8 раз больше атмосферного).
Осмотическое давление крови у разных живых организмов неодинаково. Так, у лягушек оно ниже, чем у человека, а у некоторых морских животных, наоборот, больше.
При изменении осмотического давления крови организм стремится восстановить его, удалив из крови избыточное количество растворенных частиц (если давление повышается) или, наоборот, увеличивая число кинетически активных частиц (если давление понижается). Основную роль в регуляции осмотического давления крови играют почки. В меньшей степени в сохранении изоосмии участвуют ткани печени и подкожной клетчатки. Они способны накапливать избыточные количества солей. При поражении почек вклад подкожной клетчатки в поддержание осмотического давления резко увеличивается. Содержание солей в ее клетках возрастает, что приводит вследствие осмоса к значительному увеличению объема клеток и появлению отечности.
Изоосмия регулируется, прежде всего, центральной нервной системой и деятельностью желез внутренней секреции.
Отклонение осмотического давления крови от нормы вызывает болезненное состояние. Так, при его понижении наблюдаются рвота, судороги, затемнение сознания. Повышение осмотического давления сопровождается отечностью, нарушением сердечной деятельности.
В некоторых случаях изменения осмотического давления в ограниченных участках тканей могут быть довольно большими. Так, при локальных воспалительных процессах белковые молекулы в клетках распадаются на массу более мелких фрагментов, увеличивая, тем самым, число растворенных частиц в них. Вода из окружающих тканей и сосудов устремляется в эти клетки и значительно увеличивает их объем. При этом в районе воспалительного очага возникает опухоль, при разрезе или проколе которой гнойная жидкость вытекает из нее под большим давлением.
Растворы, осмотическое давление которых равно осмотическому давлению раствора, принятого за стандарт, называются изотоническими. В медицине осмотическое давление растворов сравнивают с осмотическим давлением крови. Изотоническими по отношению к крови являются 0,9% (0,15 М) раствор NaCl и 4,5-5% раствор глюкозы. В этих растворах концентрация частиц растворенного вещества такая же, как и в плазме крови. Отличие состоит лишь в том, что в состав крови входит не только NaCl или глюкоза, но и целый ряд других веществ. Их суммарная концентрация носит название осмолярности (изотонической концентрации) и представляет собой химическое количество всех кинетически активных (т.е. способных к самостоятельному движению) частиц (независимо от их формы, размеров и природы), содержащихся в 1 литре плазмы крови.
Осмолярная концентрация крови у человека составляет 0,287-0,303 моль/л.
Изотонические растворы NaCl и глюкозы называют часто физиологическими растворами. Хотя в настоящее время этот термин для них признан неудачным, т.к., строго говоря, истинным физиологическим раствором является раствор, по своему количественному и качественному составу максимально приближенный к плазме крови.
Растворы, обладающие более высоким осмотическим давлением, чем плазма крови, называются гипертоническими, а растворы, имеющие более низкое давление – гипотоническими .
При различных лечебных процедурах в кровь человека в больших количествах следует вводить только изотонические растворы, чтобы не вызвать осмотический конфликт из-за резкого несоответствия между осмотическим давлением биологической жидкости и вводимого раствора.
При контакте клетки с гипертоническим раствором происходит отток воды из клетки через мембрану в окружающую среду. Клетка при этом теряет свою упругость вследствие обезвоживания и уменьшается в объеме (сморщивается). Нормальное течение физических и химических процессов в ней нарушается (рис. 25).
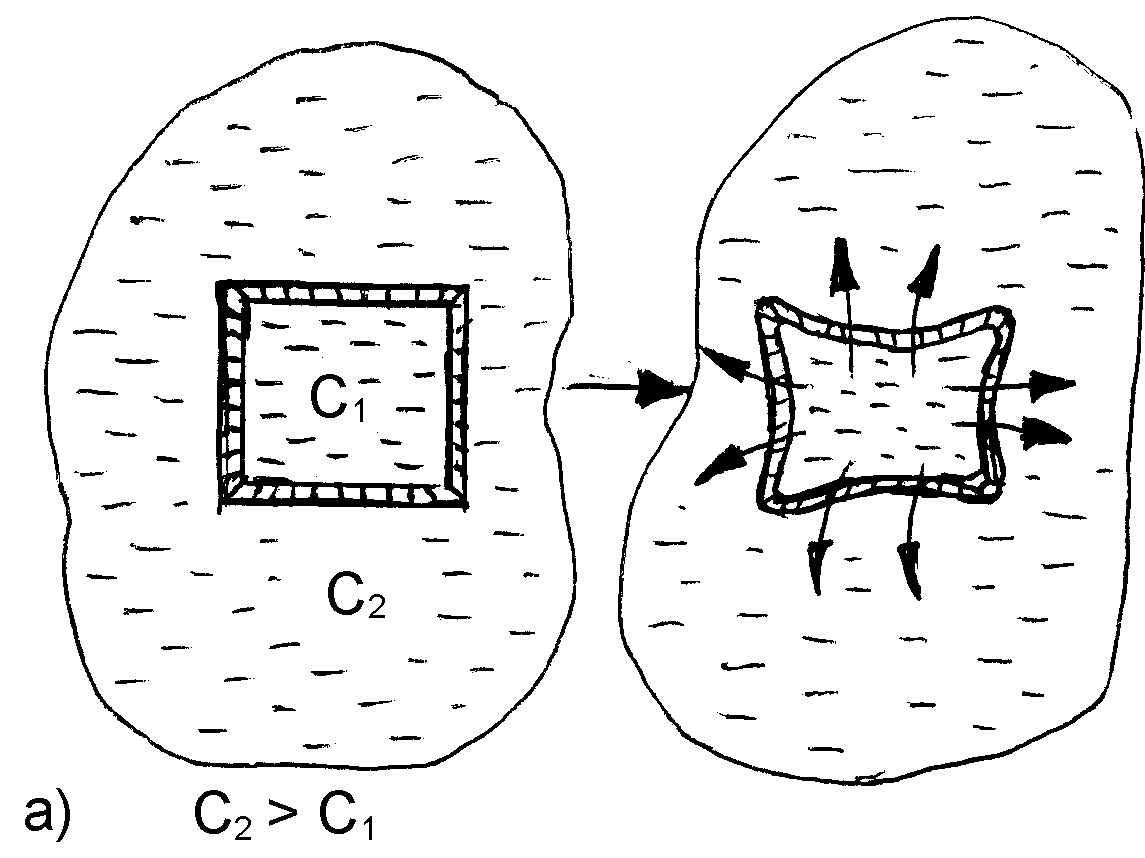
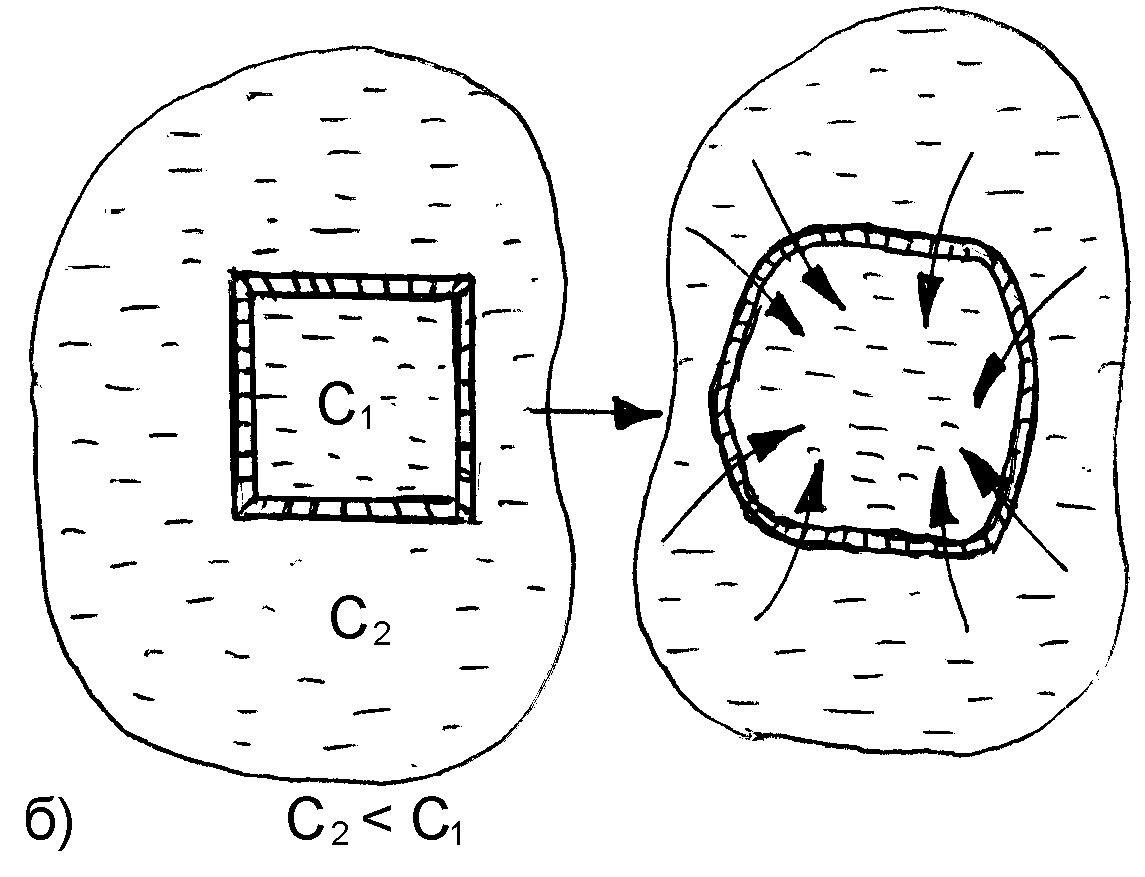
Рис. 25. Схематическое изображение процессов плазмолиза (а) и лизиса (б), протекающих в результате помещения клетки, соответственно, в гипертонический или гипотонический растворы
Данное явление называется плазмолизом или экзосмосом.
Плазмолиз в большинстве случаев является обратимым процессом. Плазмолизированные клетки, помещенные в изотонический раствор, вновь набухают, восстанавливая свою жизнедеятельность. Но при слишком сильном и продолжительном обезвоживании клетка может потерять свою жизнеспособность.
При контакте с гипотоническим раствором вода из внешней среды переходит внутрь клетки. В результате этого клетка увеличивается, и может произойти разрыв ее оболочки. Данное явление называется лизисом или эндосмосом (рис. 25).
Если в качестве клеточной культуры использовать эритроциты, то вследствие разрыва их оболочек внешняя среда окрасится гемоглобином в красный цвет. В этом случае данное явление называют иначе гемолизом (или эритроцитолизом).
Гемолиз является частным случаем более общего явления – цитолиза (разрушения животных и растительных клеток под влиянием различных причин).
В крови разрушение оболочки у всех эритроцитов наступает если ее осмотическое давление снижается до 260-300 кПа. Цвет крови при этом частично изменяется и принимает характерный, «лаковый» оттенок.
В клинической практике в некоторых случаях могут применяться не только изотонические, но и гипертонические растворы. Например, в хирургии используют марлевые полоски, смоченные в гипертоническом растворе NaCl, для наложения на гнойные раны. При этом вследствие осмоса ток жидкости направляется по марле наружу из раны, что способствует постоянному очищению раны от гноя, микроорганизмов, продуктов распада и т.д. (рис. 26).
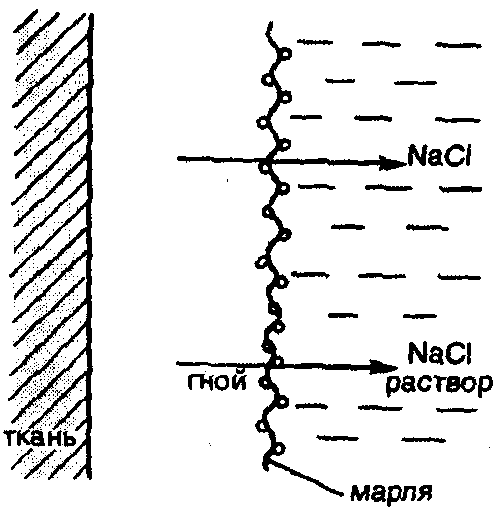
Рис. 26. Принцип применения гипертонических повязок для очистки пораженных тканей от гноя и продуктов распада
Гипертонические растворы вводят внутривенно при глаукоме, чтобы снизить внутриглазное давление из-за повышенного содержания жидкости в передней камере глаза.
Явлением осмоса объясняют слабительное действие глауберовой (Na2SO4 · 10H2O) и горькой (MgSO4 · 7H2O) солей.
Эти соли плохо всасываются в кровь и поэтому их высокая концентрация в кишечнике вызывает интенсивный переход воды внутрь его из окружающих тканей, способствуя послабляющему действию.
Многие бактериальные клетки имеют высокое осмотическое давление. При действии антибиотиков (например, пенициллина) ингибируется процесс биосинтеза стенок растущих стрептококков. Они становятся непрочными и под действием внутреннего осмотического давления легко разрушаются.
Таким образом, понимание осмотических процессов и контроль за ними, а также умение оказывать на их протекание то или иное воздействие имеет крайне важное значение в биологии и медицине.
Давление насыщенного пара растворителя
над раствором. Закон Рауля
Если в замкнутый сосуд, из которого предварительно удалили воздух, поместить чистый растворитель, например, воду (рис. 27), то в результате естественного процесса испарения над жидкостью образуется пар. Он будет состоять из молекул жидкости, оторвавшихся от ее верхнего слоя в результате своего хаотического теплового движения и перешедших в газовую фазу. На совершение данного процесса необходимо затратить определенное количество энергии, чтобы преодолеть силы притяжения между молекулами жидкой фазы. Эндотермический процесс испарения обратим. По мере накопления молекул в газовой фазе над поверхностью жидкости одновременно начнет протекать и обратный процесс – конденсация пара, т.е. переход молекул растворителя обратно в жидкость. Причем конденсация является экзотермическим процессом и сопровождается выделением теплоты.
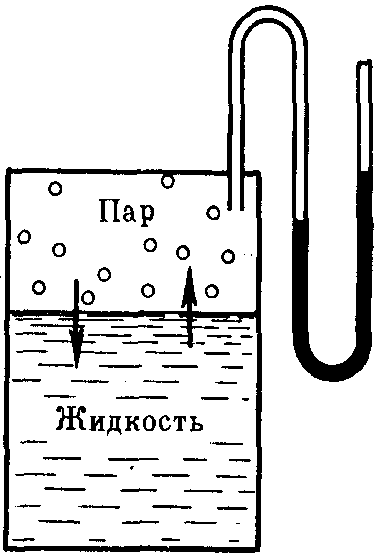
Рис. 27. Равновесие жидкость – пар (схема)
Со временем скорости обоих процессов уравняются и в системе установится динамическое равновесие, при котором число молекул растворителя, испарившихся с поверхности жидкости за единицу времени, будет равно числу молекул, перешедших в жидкость из газообразной среды. Но при этом какое-то постоянное и не меняющееся во времени число молекул растворителя будет находиться над его поверхностью, образуя насыщенный пар. Давление этого пара на жидкость называют давлением насыщенного пара чистого растворителя (р0). Его можно измерить с помощью манометра (рис. 27).
При неизменной температуре и внешнем давлении р0 остается постоянным, зависит только от природы жидкости и поэтому является одной из ее физических характеристик.
Так, при 293 K (20оС) давление насыщенного пара Н2О равно 2,319 кПа; этилового спирта – 5,85 кПа; диэтилового эфира – 58,93 кПа.
При повышении температуры согласно принципу Ле-Шателье равновесие смещается в сторону эндотермического процесса испарения. В результате чего количество молекул жидкости над ее поверхностью начнет увеличиваться. Это приведет к возрастанию давления насыщенного пара, когда система снова придет в равновесие.
Если растворить небольшое количество какого-нибудь нелетучего вещества[1] (молекулы которого не могут переходить в газовую фазу), концентрация свободных молекул растворителя в верхнем слое жидкости уменьшится, т.к. часть мест там займут частицы растворенного вещества. Они к тому же будут удерживать вокруг себя (связывать) ближайшие молекулы растворителя, формируя из них сольватные оболочки.
В этом случае равновесие между жидкостью и ее насыщенным паром устанавливается при более низком давлении (р) по сравнению с давлением насыщенного пара над чистым растворителем (р0).
Опытным путем было установлено, что для растворов понижение давления насыщенного пара растворителя (р0 – р = Dр) не зависит от природы растворенного вещества, а определяется только его концентрацией.
Французский физик Франсуа Рауль установил математическую зависимость между р и мольной долей растворителя, которая называется законом Рауля:
р = р0c2,
где c2 – мольная доля растворителя в растворе.

Франсуа Мари Рауль (1830 – 1901) – французский химик и физик, член-корреспондент Парижской АН (1890). С 1867 работал в Гренобльском университете (профессор с 1870). Член-корреспондент Петербургской АН (1899). Исследуя в 1882–1888 понижение температуры кристаллизации, а также понижение давления пара (или повышение температуры кипения) растворителя при введении в него растворённого вещества, открыл закон, применяемый для определения молекулярных масс веществ в растворённом состоянии (закон Рауля).
Дата публикования: 2014-11-03; Прочитано: 7108 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
