 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Термодинамические параметры
|
|
Физические величины, характеризующие какое-либо свойство системы, называются термодинамическими параметрами. Они могут быть микроскопическими и макроскопическими .
Совокупность значений размеров и масс всех частиц (молекул либо ионов), составляющих систему, их положений в пространстве, скоростей движения и т.д. называется набором микроскопических параметров.
Величины, характеризующие всю систему в целом (давление, объем, температура, масса, плотность и т.д.) называются макроскопическими параметрами.
Некоторые макроскопические параметры системы (масса, внутренняя энергия) могут быть заданы как сумма соответствующих микроскопических параметров.
Макроскопические параметры делятся на 2 группы: экстенсивные и интенсивные параметры.
Экстенсивными называются такие параметры, значения которых для всей системы равны сумме значений этих же параметров для отдельных частей системы (например, масса, объем).
Значения интенсивных параметров одинаковы как для всей системы в целом, так и для любой ее части (например, температура, давление, плотность).
Совокупность численных значений термодинамических параметров системы, характеризующих ее физические и химические свойства (присущие ей в данный момент времени), называется иначе состоянием системы .
Если значения параметров не меняются во времени, такое состояние системы называется равновесным. В строго равновесном состоянии может находиться только изолированная система.
Для открытых и закрытых систем значения термодинамических параметров тоже могут оставаться неизменными во времени. Но при этом часто наблюдается равноценный в обе стороны обмен энергией с внешней средой (для закрытых систем) или энергией и веществом (для открытых систем). Такое состояние называется стационарным (рис. 4).
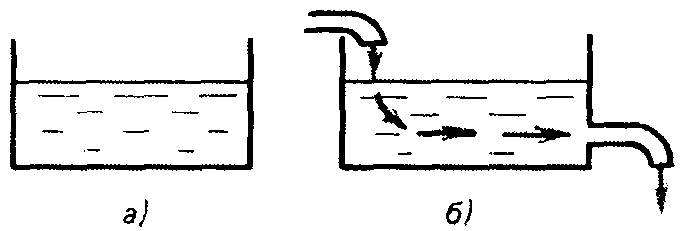
Рис. 4. Гидродинамическая модель равновесного (а) и стационарного (б) состояний
Состояние системы может быть выражено как набором значений ее микроскопических параметров (микросостояние системы), так и набором значений макроскопических параметров (макросостояние системы).
Обычно данному макросостоянию системы присуще определенное число ее микросостояний (как правило, очень большое). Исключение составляет идеальный кристалл, находящийся при Т = 0оK. В этом случае всякое движение молекул (поступательное, колебательное) отсутствует, их местоположение в пространстве остается неизменным сколь угодно долгое время. Поэтому данное макросостояние может характеризоваться только одним набором микроскопических параметров.
Изменение во времени значений одного или нескольких макроскопических параметров системы называют иначе термодинамическим процессом .
В ходе термодинамического процесса система из одного равновесного состояния переходит в другое равновесное состояние, характеризующееся иным набором значений своих параметров.
Процесс, протекающий с изменением химического состава системы, называется химической реакцией .
Сумму всех процессов, которые вывели систему из начального состояния, а затем вернули ее в это же состояние, называют круговым процессом или циклом.
Все процессы, встречающиеся в природе, можно разделить на самопроизвольные и несамопроизвольные.
Самопроизвольными называются такие процессы, для протекания которых не требуется оказания на систему внешнего воздействия. Например, переход теплоты от более нагретого тела к менее нагретому телу, растворение соли в Н2О, смешивание нескольких газов.
Несамопроизвольными называются процессы, требующие для своих протеканий затрат энергии извне. Например, разделение смеси газов на составляющие компоненты, перемещение против действия сил тяжести, уменьшение объема системы.
Термодинамические процессы подразделяются также на обратимые и необратимые, равновесные и неравновесные.
Процесс называется термодинамически обратимым, если его можно провести и в прямом, и в обратном направлении через одни и те же промежуточные стадии, без каких-либо энергетических изменений в окружающей среде.
Обратимые процессы являются также и равновесными.
Реализовать их на практике можно через бесконечное число промежуточных стадий, каждая из которых отличается от исходного равновесного состояния на бесконечно малую величину.
Таким образом, скорость протекания обратимого процесса бесконечно мала, поэтому осуществить его можно за бесконечно длительное время.
Реальные процессы, протекающие в природе, являются термодинамически необратимыми и неравновесными.
Строгому математическому описанию поддаются идеализированные обратимые процессы. Для необратимых процессов удается составить лишь неравенство. Поэтому, только заменив реальный необратимый процесс на идеализированный обратимый, можно ответить на вопрос, возможен ли он вообще и при каких условиях.
Следует отметить, что термодинамическая обратимость отличается от химической обратимости. Химическая обратимость характеризует направление процесса, а термодинамическая - способ его проведения.
Дата публикования: 2014-11-03; Прочитано: 1785 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
