 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Теория атома Бора
|
|
Со времен Древней Греции вплоть до конца XIX в. считалось, что все тела состоят из мельчайших частиц – атомов, которые являются неделимыми частицами материи, «кирпичиками мироздания». Всякое проявление существования материи сводилось к механическому перемещению этих частиц. О том, что атомы являются сложными частицами материи, первым догадался только Д. И. Менделеев. По его мнению, атомы были неделимы лишь известными в то время химическими методами.
К концу XIX в. были установлены некоторые свойства атомов, свидетельствовавшие о том, что они имеют сложный состав. Было обнаружено, что в электрическом разряде в газе возникают так называемые катодные лучи, представляющие собой потоки отрицательно заряженных частиц, названных электронами. Установлено, что электроны вырываются из атомов, которые при этом становятся положительно заряженными ионами. Стало очевидным, что атомы являются сложной системой, в которой частицы, несущие отрицательный заряд, имеют одинаковую природу для всех атомов. В тоже время положительный заряд связан с основной массой атома, но ничего не было известно о том, как этот заряд распределяется внутри атома.
В 1903 г. Д. Д. Томсон предложил первую модель, согласно которой атом представляет собой сферу, заполненную положительно заряженной материей, в которой взвешены отрицательно заряженные корпускулы – электроны. Томсон рассчитал размер такого шарика исходя из соображений, что электрон внутри сферы-атома совершает колебания с частотой, определяемой его удаленностью от центра сферы. Полученное таким образом значение радиуса атома (≈ 3·10–8 см) совпадало по порядку величины с газокинетическими размерами. Это совпадение являлось весомым доказательством справедливости модели, но как позже выяснилось, было случайным.
Главное, чего не могла объяснить теория Томсона, это наличия в спектре излучения атомов множества линий. Ведь если электрон один (как в атоме водорода), то и линия должна быть одна, длина волны этой линии должна соответствовать частоте колебания электрона в атоме. Эксперимент же показал, что линий в спектре атома гораздо больше, чем электронов в его составе. К тому моменту уже было известно, что все атомы при определенных условиях испускают волны, частоты которых подчиняются определенным правилам. Для каждого атома набор линий является исключительно индивидуальным, как отпечатки пальцев для человека.
Получить спектр атома, иона или молекулы можно с помощью прибора, снабженного устройством, разделяющим излучение на монохроматические составляющие (кварцевая или стеклянная призма, дифракционная решетка). Кроме того, необходимо заставить частицу излучать, т.е. перевести вещество в возбужденное состояние. Это может наблюдаться при различных видах электрического разряда через исследуемое вещество (гейслерова трубка, искра, дуговой разряд), при бомбардировке атомов газа электронами, испущенными накаленным катодом, при нагревании паров и газов (например, в пламени горелки), при освещении паров светом подходящей длины волны и т.д. Способ возбуждения подбирают исходя из свойств конкретного вещества. Так для наблюдения спектра атомов йода достаточно нагреть над пламенем запаянную кювету с кристаллическим йодом. Получение спектров золота или свинца (или еще более тяжелых элементов) уже требует помещения исследуемого вещества в дуговой разряд, происходящий в промежутке между электродами.
Наиболее простой вид имеют спектры атома водорода и водородоподобных ионов, а также других изолированных атомов. Электроны, входящие в их состав, находятся под действием внутриатомных сил и не испытывают воздействия со стороны окружающих атомов. Спектры излучения этих частиц представляют собой несколько серий дискретных линий разной интенсивности. Такой спектр называют линейчатым. По мере перехода от более длинных волн к более коротким уровни постепенно сгущаются.
С помощью стеклянной призмы глаз человека увидит только несколько линий одной из серий спектра атома водорода (рис. 3.1):
λ = 656 нм (красный цвет), λ = 486 нм (зелено-голубой цвет)
λ = 434 нм (сине-фиолетовый цвет) и λ = 410 нм (темно-фиолетовый цвет)
Поэтому свечение возбужденного водорода имеет розоватую окраску (смесь указанных цветов).

Рис. 3.1. Видимая часть спектра атома водорода

Рис. 3.2. Видимая часть спектра атома железа
Уединённый атом имеет бесконечно много уровней. В реальной среде различные взаимодействия с соседними частицами приводят к тому, что у атома остаётся только конечное число нижних уровней. Например, в условиях звёздных атмосфер в спектре атома водорода обычно различают 20 – 30 линий, но в разреженном межзвёздном газе могут наблюдаться сотни уровней, но не более тысячи. Число линий в спектре атома железа даже в земных условиях составляет несколько тысяч (рис. 3.2).
Некоторое время ученые пытались как-то систематизировать линии в спектрах атомов. Первым успеха добился швейцарский физик Бальмер. Изучая спектр атома водорода в 1885 г. он обнаружил, что длины волн линий из серии, располагающейся в видимом диапазоне, удивительно точно описываются формулой:  (3.1)
(3.1)
где λ0 – константа, n – целое число, принимающее значения 3, 4, 5 и т.д.
Если длину волны выразить через частоту, получится формула:
 (3.1’)
(3.1’)
где R = 3,29·1015 с–1 – постоянная Ридберга.
Формула (3.1’) называется формулой Бальмера, а соответствующая серия спектральных линий – серией Бальмера. Исследования показали, что другие серии линий, лежащие в далекой ультрафиолетовой, а также в инфракрасной областях спектра, также подчиняются аналогичным формулам:
в ультрафиолетовой области –
серия Лаймана:
 (n = 2, 3, 4,...);
(n = 2, 3, 4,...);
в инфракрасной области –
серия Пашена:
 (n = 4, 5, 6,...),
(n = 4, 5, 6,...),
серия Брэкета:
 (n = 5, 6, 7,...),
(n = 5, 6, 7,...),
серия Пфунда:
 (n = 6, 7, 8,...),
(n = 6, 7, 8,...),
и т.д.

Рис. 3.3. Энергетические состояния атома и серии спектральных линий
Все серии в спектре атома водорода могут быть описаны одной формулой, называемой обобщенной формулой Бальмера:
 (3.2)
(3.2)
где т задает номер серии и имеет для данной серии постоянное значение: m = 1, 2, 3,..., п может принимать значения m + 1, m + 2,... и определяет отдельные линии в серии. Первая линия в серии, которой соответствует самая большая длина волны, называется головной линией – в серии Бальмера спектра атома водорода это красная линия (рис. 3.1). При возрастании n частота линии в каждой серии стремится к предельному значению 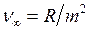 , которое называется границей серии.
, которое называется границей серии.
Линейчатый вид имеют спектры и других атомов. Однако количество линий в спектрах этих атомов значительно больше и взаимное расположение гораздо сложнее.
Итак, характер излучения атомов свидетельствует об их достаточно сложном строении. В 1903 г. Ленард, изучая прохождение быстрых электронов через металлическую фольгу, пришел к выводу, что атом имеет «ажурное» строение, то есть заряд никак не может быть равномерно распределен по объему атома. Стоит добавить, что в то время еще не был открыт электрон как частица, поэтому выводы Ленарда сводились к тому, что через «непрозрачное окно», коим являлась фольга, проникает что-то, несущее отрицательный заряд. Этот факт казался на том момент удивительным.
В 1913 г. Эрнест Резерфорд предпринял попытку прозондировать атом изнутри. В качестве зонда он использовал α -частицы, выделяющиеся при радиоактивном распаде сложных атомов.

Рис. 3.4. Опыт Резерфорда
Оказалось, что при прохождении α -частиц через слой какого-либо вещества (например, через фольгу из золота) наблюдается изменение направления их движения (рассеяние). Отклонившуюся частицу можно зарегистрировать с помощью экрана, покрытого веществом, которое при попадании в него α -частицы, откликается вспышкой света.

Рис. 3.5. Резерфордовское рассеяние
На рис. 3.5 показана траектория отклонения α -частицы при попадании в кулоновское поле ядра. Резерфорд показал, что угол отклонения α -частицы зависит от величины так называемого прицельного параметра b. Можно рассчитать минимальный прицельный параметр b, при котором частица отклонится от прямолинейной траектории, то есть ощутит действие поля ядра:
 (3.3)
(3.3)
где b - прицельный параметр, θ - угол рассеяния.
Угол θ также называют углом рассеяния. Из формулы (3.3) видно, что чем меньше b, тем больше угол рассеяния. Если θ > 0, следовательно, частица претерпевает рассеяние.
Было очевидно, что отклонение происходит в результате взаимодействия α -частиц с зарядами, входящими в состав атома. Поскольку столкновение с электроном не может вызвать заметного изменения траектории α -частицы (ее масса в 7000 раз больше массы электрона), Резерфорд пришел к выводу, что сильное отклонение направления движения α -частицы от первоначального происходит в результате ее столкновения с положительно заряженной частью атома. Причем весь положительный заряд сконцентрирован в области, названной ядром и не превышающей 10–12 см. Электроны для поддержания устойчивого равновесия должны находиться в постоянном движении вокруг ядра в области размером порядка 10–8 см.
Резерфорд предложил, что электроны вращаются по замкнутым траекториям вокруг ядра как планеты вокруг Солнца. Эти идеи представляют суть ядерной модели атома Резерфорда, которая в качестве приближенной модели не потеряла значения до наших дней. Однако рассмотрение атома по этой модели с опорой на классическую электродинамику предсказывает следующий результат: электрон двигается по искривленной орбите вокруг ядра, центростремительное ускорение электрона определяется кулоновской силой, действующей на электрон со стороны положительного ядра:
 (3.4)
(3.4)
где Ze – заряд ядра атома, при Z = 1 такая система соответствует атому водорода, при иных Z – водородоподобному иону – атому с зарядом ядра Z, у которого удалены все электроны, кроме одного.
Итак, движение электрона будет заведомо ускоренным, а согласно законам классической электродинамики ускоренно движущийся электрон должен непрерывно испускать электромагнитные волны. В частности при равномерном движении электрона по окружности частота излучения будет равна циклической частоте, при более сложных видах движения должно наблюдаться наложение нескольких монохроматических частотных компонентов. Излучение атома будет сопровождаться уменьшением энергии системы, а вместе с ней будет уменьшаться радиус вращения электрона и период его обращения, что в свою очередь приведет к уменьшению частоты излучения (рис. 3.6.а). Такая система будет излучать непрерывный спектр, и через 10–11с вследствие потери энергии электрон упадет на ядро, т.е. атом как таковой прекратит свое существование. Эти выводы не имеют ничего общего с экспериментальными данными.

Рис. 3.6. Классическая (а) и боровская (б) модели атома
В том же 1913 г. решение проблемы было предложено Нильсом Бором. Опираясь на квантовую теорию Планка, он пошел вразрез с классической электродинамикой. Необходимо отметить, что на тот момент не была разработана электродинамика нового образца, поэтому идеи Бора не были следствием логических выводов на основании законов физики. Однако с их помощью можно было получить множество удивительных результатов, безоговорочно согласующихся с действительностью. Итак, развивая теорию Резерфорда, Бор высказал следующие постулаты:
1. Атом может длительное время находиться только в определенных, так называемых стационарных состояниях, которые характеризуются дискретными значениями энергии Е1, Е2, Е3,... В этих состояниях, вопреки классической электродинамике, атом не излучает.
2. При переходе атома из стационарного состояния с большей энергией Е2 в стационарное состояние с меньшей энергией Е1 происходит излучение кванта света (фотона) с энергией ħω:
 (3.5)
(3.5)
С точки зрения классической физики в атоме возможно бесконечно большое число орбит. Для определения, какие именно орбиты действительно возможны в атоме, Бор вращение электрона вокруг ядра представил как колебания, частота которых согласно постулату Планка (см. формулу 1.19) определяется из условия:  (3.6)
(3.6)
где n – целое число.
Можно показать, что условие квантования энергии электрона сведется к ограничению, которое накладывается на момент импульса механического вращательного движения электрона вокруг ядра – момент импульса электрона может принимать только определенные дискретные значения:
 (n = 1, 2, 3,...) (3.7)
(n = 1, 2, 3,...) (3.7)
откуда  (3.8)
(3.8)
Подставим (3.8) в (3.4):  (3.9)
(3.9)
Выразив отсюда r, получим значения радиусов орбит электрона в атоме:
 (n = 1, 2, 3,...) (3.10)
(n = 1, 2, 3,...) (3.10)
Радиус первой орбиты атома водорода называется боровским радиусом, его значение равно  (3.11)
(3.11)
В спектроскопии частоты спектральных линий представляют в виде разности положительных чисел T(n), называемых термами. Для атома водорода  . Для других атомов терм имеет более сложный вид. Для любого атома выполняется правило, названное комбинационным принципом Ритца: частоты спектральных линий излучения любого атома могут быть представлены в виде разности двух термов; составляя различные комбинации термов, можно найти все возможные частоты спектральных линий этого атома.
. Для других атомов терм имеет более сложный вид. Для любого атома выполняется правило, названное комбинационным принципом Ритца: частоты спектральных линий излучения любого атома могут быть представлены в виде разности двух термов; составляя различные комбинации термов, можно найти все возможные частоты спектральных линий этого атома.
Частота фотона, излучаемого при переходе из состояния n в состояние m, определяется формулой:
 (3.12)
(3.12)
Согласно второму постулату Бора и формуле (3.5)
 (3.13)
(3.13)
Сопоставив формулы (3.12) и (3.13) получаем:
 (3.14)
(3.14)
Таким образом, понятие терм отражает энергию электрона в данном состоянии атома.
Энергия фотона мала, поэтому ее принято измерять в электрон-вольтах. 1 электрон-вольт (эВ) – это энергия, которую приобретает частица с зарядом, равным заряду электрона (| е| = 1.601·10–9 Кл), при прохождении разности потенциалов в 1 В. 1 эВ = 1.601·10–19 кулон·вольт = 1.601 · 10–19 джоуль.
Теория Бора имела огромное значение в развитии физики микромира. Совпадение ее результатов с экспериментальными данными для атома водорода указало на то, что рассматривать микроскопические объекты необходимо с квантовой точки зрения, что классические методы категорически неприменимы в данной ситуации. Однако существенным недостатком теории было именно некорректное совмещение квантовых подходов с классическими методами (не смотря на понимание их невыполнимости). Этот недостаток отчетливо выразился уже при расчете атома гелия, о более сложных атомах и думать было бессмысленно. Кроме того, теория Бора предсказывала излучательный переход, но не говорила, с какой скоростью этот переход осуществляется, не давала информации об относительной интенсивности спектральных линий. Несмотря на все недостатки, старая боровская теория основана на наглядной физической модели, дает правильные энергии уровней атома водорода и часто оказывается полезной для интерпретации результатов квантовомеханических расчетов.
Дата публикования: 2014-11-04; Прочитано: 1441 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
