 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Распределение молекул по скоростям
|
|
Опыт показывает, что скорости молекул газа, который находится в равновесном состоянии, могут иметь самые разные значения – и очень большие, и близкие к нулю. Скорость молекул может принимать любые значения от 0 до некоторого значения  . Это происходит вследствие многочисленных случайных столкновений молекул друг с другом и обмена энергиями. Скорость молекулы – непрерывная случайная величина. Но неправомерно ставить вопрос, какова вероятность того, что скорость молекулы равна, например, 110,25 м/с. Если бы была возможность одновременно и совершенно точно измерить скорости всех молекул в данном объеме газа, то среди них не нашлось бы молекулы точно с такой скоростью, но были бы молекулы, со скоростями, близкими к этому значению. Таким образом, можно говорить лишь о вероятности
. Это происходит вследствие многочисленных случайных столкновений молекул друг с другом и обмена энергиями. Скорость молекулы – непрерывная случайная величина. Но неправомерно ставить вопрос, какова вероятность того, что скорость молекулы равна, например, 110,25 м/с. Если бы была возможность одновременно и совершенно точно измерить скорости всех молекул в данном объеме газа, то среди них не нашлось бы молекулы точно с такой скоростью, но были бы молекулы, со скоростями, близкими к этому значению. Таким образом, можно говорить лишь о вероятности 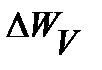 того, что величина скорости молекулы лежит в некотором интервале [
того, что величина скорости молекулы лежит в некотором интервале [  ]. Эту вероятность можно определить так же, как это делалось в предыдущем примере с шарами:
]. Эту вероятность можно определить так же, как это делалось в предыдущем примере с шарами:
 , (4.2.2)
, (4.2.2)
где  - число молекул, величина скорости которых лежит в указанном выше интервале, N – общее число молекул газа.
- число молекул, величина скорости которых лежит в указанном выше интервале, N – общее число молекул газа.
Очевидно, что  должна зависеть от величины
должна зависеть от величины  (чем больше
(чем больше  , тем большее число молекул имеют скорости, попадающие в этот интервал) и от самого значения скорости V.
, тем большее число молекул имеют скорости, попадающие в этот интервал) и от самого значения скорости V.
Отложим интервал возможных значений скорости [ 0,  ] на оси абсцисс. Разобьем весь интервал на отрезки, шириной
] на оси абсцисс. Разобьем весь интервал на отрезки, шириной  V. На этих отрезках построим столбики, высота которых равна
V. На этих отрезках построим столбики, высота которых равна 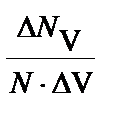 , что представляет собой плотность вероятности
, что представляет собой плотность вероятности  нахождения молекул в интервале скоростей
нахождения молекул в интервале скоростей  . Полученная столбчатая диаграмма, называется гистограммой (рис. 4.2.1. а), она дает наглядное представление о распределении молекул по скоростям. Площадь каждого столбика будет равна
. Полученная столбчатая диаграмма, называется гистограммой (рис. 4.2.1. а), она дает наглядное представление о распределении молекул по скоростям. Площадь каждого столбика будет равна  . Полная площадь гистограммы, в соответствии с условием нормировки, равна единице:
. Полная площадь гистограммы, в соответствии с условием нормировки, равна единице:
 , (4.2.3)
, (4.2.3)
что физически означает равенство единице полной вероятности W нахождения молекул во всем интервале скоростей – от нуля до бесконечности.
Здесь  - есть число молекул, движущихся со скоростью V, лежащей в интервале значений
- есть число молекул, движущихся со скоростью V, лежащей в интервале значений  , а
, а  - есть относительное число молекул, обладающих скоростью V в указанном выше интервале скоростей.
- есть относительное число молекул, обладающих скоростью V в указанном выше интервале скоростей.

Рис. 4.2.1 а. Гистограмма распределения молекул по скоростям
В пределе при ∆v→ 0 огибающая столбиков превращается в гладкую кривую (рис. 4.2.1 б), которую можно задать аналитически в виде функции F (V). Эта функция носит название плотности вероятности распределения молекул по скоростям, или просто функции распределения молекул по скоростям. Тогда вероятность  того, что величина скорости молекулы лежит в интервале [V; V +d V], равна
того, что величина скорости молекулы лежит в интервале [V; V +d V], равна
 (4.2.4)
(4.2.4)
и определяется площадью заштрихованной фигуры, представленной на рис. 4.2.1 б.
. 
Рис. 4.2.1 б. График функции распределения молекул по скоростям.
С другой стороны,  равна относительному числу молекул, скорости которых лежат в указанном выше интервале:
равна относительному числу молекул, скорости которых лежат в указанном выше интервале:
 ,
,
где  число молекул, скорости которых лежат в интервале [V, V+dV].
число молекул, скорости которых лежат в интервале [V, V+dV].
По аналогии с условием нормировки (4.2.3) полная площадь фигуры на рис. 4.2.1 б, ограниченной осями координат и кривой F( V ), имеет смысл полной вероятности и равна единице:
 (4.2.5)
(4.2.5)
Функция распределения F (V) молекул газа по абсолютным значениям скоростей была получена Дж. К. Максвеллом и является справедливой для идеального газа, состоящего из одинаковых частиц, находящегося в состоянии равновесия, в отсутствие внешних силовых полей. В этом случае температура, концентрация, давление имеют одинаковое по всей системе значение. Аналитически функция F (V) задается следующим выражением:
 , (4.2.6)
, (4.2.6)
где константа С находится из условия нормировки (4.2.6).
Выражение для функции распределения F (v) справедливо во всем диапазоне скоростей от нуля до бесконечности. Вид этой функции представлен на рис. 4.2.2.

Рис. 4.2.2. График функции Максвелла для распределения молекул по скоростям.
Поскольку при возрастании скорости v множитель вида  убывает быстрее, чем растет множитель
убывает быстрее, чем растет множитель  , функция F (v), начинаясь в нуле (из-за
, функция F (v), начинаясь в нуле (из-за  ), достигает максимума и затем асимптотически стремится к нулю. Площадь, охватываемая кривой, равна единице – в соответствии с условием нормировки (4.2.5).
), достигает максимума и затем асимптотически стремится к нулю. Площадь, охватываемая кривой, равна единице – в соответствии с условием нормировки (4.2.5).
После подстановки выражения (4.2.6) в условие нормировки получим

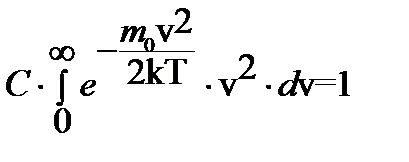 . (4.2.7)
. (4.2.7)
Вычислим интеграл и получим выражение для константы С:
 (4.2.8)
(4.2.8)
С учетом этого результата функцию Максвелла – функцию распределения молекул по скоростям можно записать в следующем виде:
 (4.2.9)
(4.2.9)

Рис. 4.2.3. Вид функции  при различных температурах
при различных температурах
При увеличении температуры максимум функции, в соответствии с формулой (4.2.25), сдвигается в сторону больших значений скорости, а сам максимум становится ниже, поскольку, в соответствии с условием нормировки (4.2.5), площадь под кривой  остается постоянной и равной единице.
остается постоянной и равной единице.
В формулах (4.2.8) и (4.2.9) отношение  иногда удобнее заменить отношением
иногда удобнее заменить отношением 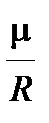 , что удобнее, так как молярную массу газа можно определить без труда в соответствии с формулами (4.1.2)…(4.1.4):
, что удобнее, так как молярную массу газа можно определить без труда в соответствии с формулами (4.1.2)…(4.1.4):  ,
,
где m 0 - масса одной молекулы  , а постоянная Больцмана k связана с универсальной газовой постоянной R соотношением:
, а постоянная Больцмана k связана с универсальной газовой постоянной R соотношением:
 (4.2.10)
(4.2.10)
Умножив соответствующую вероятность  на полное число молекул газа
на полное число молекул газа  , получим число молекул
, получим число молекул  , модуль скорости которых лежит в указанном выше узком интервале значений величин скоростей. Чтобы найти число молекул
, модуль скорости которых лежит в указанном выше узком интервале значений величин скоростей. Чтобы найти число молекул  , модуль скорости которых лежит в пределах значений от
, модуль скорости которых лежит в пределах значений от  до
до  , необходимо провести интегрирование:
, необходимо провести интегрирование:
 .
.

Рис. 4.2.4. График функции Максвелла  с указанием наиболее вероятной, средней и средней квадратичной скоростей.
с указанием наиболее вероятной, средней и средней квадратичной скоростей.
Функция Максвелла  (рис. 4.2.4.) имеет максимум при значении скорости
(рис. 4.2.4.) имеет максимум при значении скорости
 , (4.2.11)
, (4.2.11)
которое вычисляется из условия  и называется наиболее вероятной скоростью.
и называется наиболее вероятной скоростью.
Средняя скорость молекул  определяется по формуле:
определяется по формуле:  . (4.2.12).
. (4.2.12).
среднее значение квадрата скорости  найдем по формуле:
найдем по формуле:

.(4.2.13)
Средней квадратичной скоростью называется величина
 . (4.2.14)
. (4.2.14)
Дата публикования: 2014-11-04; Прочитано: 1308 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
