 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Карбонаты
|
|
Карбонат натрия Na2CO3. Оксосоль. Техническое название кальцинированная сода. Белый, при нагревании плавится и разлагается. Чувствителен к влаге и углекислому газу в воздухе. Образует декагидрат (кристаллическая сода). Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Разлагается сильными кислотами. Восстанавливается коксом. Вступает в реакции ионного обмена.
Качественная реакция на ион СО32‑ – образование белого осадка карбоната бария, разлагаемого сильными кислотами (НCl, HNO3) с выделением углекислого газа.
Применяется для синтеза соединений натрия, устранения «постоянной» жесткости пресной воды, в производстве стекла, мыла и других моющих средств, целлюлозы, минеральных красок, эмалей. В природе содержится в грунтовых рассолах, рапе соляных озер.
Уравнения важнейших реакций:
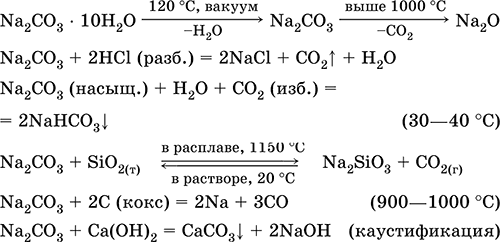

Получение в промышленности (способ Сольве, 1861–1863):
а) через насыщенный раствор NaCl пропускают смесь NH3 и СO2:
NaCl + NH3 + Н2O + СO2 = NH4Cl + NaHCO3↓
(в этих условиях питьевая сода малорастворима);
б) осадок NaHCO3 подвергают обезвоживанию (кальцинированию):
2NaHCO3 = Na2CO3 + Н2O + СO2
Карбонат калия К2СO3. Оксосоль. Техническое название поташ. Белый, гигроскопичный. Плавится без разложения, при дальнейшем нагревании разлагается. Чувствителен к влаге и углекислому газу в воздухе. Очень хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Разлагается сильными кислотами. Вступает в реакции ионного обмена.
Применяется в производстве оптического стекла, жидкого мыла, минеральных красок, многих соединений калия, как дегидратирующий агент.
Уравнения важнейших реакций:

Получение в промышленности:
а) нагревание сульфата калия [природное сырье – минералы каинит KMg(SO4)Cl ЗН2O и шёнит K2Mg(SO4)2 • 6Н2O] с гашёной известью Са(ОН)2 в атмосфере СО (давление = 15 атм):
K2SO4 + Са(ОН)2 + 2СО = 2K(HCOO) + CaSO4
б) прокаливание формиата калия К(НСОО) на воздухе:
2K(HCOO) + O2 = К2СO3 + Н2O + СO2
Гидрокарбонат натрия NaHCO3. Кислая оксосоль. Техническое название питьевая сода. Белый рыхлый порошок. При слабом нагревании разлагается без плавления, во влажном состоянии начинает разлагаться при комнатной температуре. Умеренно растворим в воде, гидролизуется по аниону в небольшой степени. Разлагается кислотами, нейтрализуется щелочами. Вступает в реакции ионного обмена.
Качественная реакция на ион НСОд – образование белого осадка карбоната бария при действии баритовой воды и разложение осадка сильными кислотами (НCl, HNO3) с выделением углекислого газа. Применяется в пищевой промышленности, как лекарственное средство.
Уравнения важнейших реакций:

Получение: насыщение раствора Na2CO3 (см.) углекислым газом.
Карбонат кальция СаСO3. Оксосоль. Распространенное природное вещество, главная составная часть осадочной горной породы – известняка (его разновидности – мел, мрамор, известковый туф, мергель), чистый СаСO3 в природе – это минерал кальцит. Белый, при прокаливании разлагается, плавится под избыточным давлением СO2. Нерастворим в воде (= 0,0007 г/100 г Н2O).
Реагирует с кислотами, солями аммония в горячем растворе, коксом. Переводится в раствор действием избытка углекислого газа с образованием гидрокарбоната Са(НСO3)2(существует только в растворе), который определяет «временную» жесткость пресной воды (вместе с солями магния и железа). Устранение жесткости (умягчение воды) проводится кипячением или нейтрализацией гашёной известью.
Применяется для производства СаО, СO2, цемента, стекла и минеральных удобрений [в том числе известковой селитры Ca(NO3)2 4Н2O], как наполнитель бумаги и резины, строительный камень (щебень) и компонент бетона и шифера, в виде осажденного порошка – для изготовления школьных мелков, зубных порошков и паст, смесей для побелки помещений.
Уравнения важнейших реакций:

Дата публикования: 2014-11-04; Прочитано: 3858 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
