 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Углерод в свободном виде
|
|
Углерод – элемент 2‑го периода и IVA‑группы Периодической системы, порядковый номер 6. Химия углерода – это в основном химия органических соединений; неорганических производных углерода не так много. Электронная формула атома [3He]2s22p2, характерные степени окисления 0, ‑IV, +II и +IV, состояние CIV считается устойчивым.
Шкала степеней окисления углерода:

Углерод имеет среднюю для неметаллов электроотрицательность (2,50), проявляет неметаллические (кислотные) свойства. Неорганические углеродсодержащие вещества – оксиды, угольная кислота и ее соли, бинарные соединения; органические вещества – практически неограниченное число соединений с водородом (углеводороды) и их производных, содержащих различные по длине цепи и циклы атомов углерода.
В природе – одиннадцатый по химической распространенности элемент (четвертый среди неметаллов). Встречается в самородном состоянии (алмаз, графит) и в виде соединений. Жизненно важный элемент для всех организмов.
Аллотропные формы углерода С. В свободном виде углерод существует в виде четырех аллотропных модификаций: графит, алмаз, карбин и фуллерен.
Г р а ф и т – устойчивая аллотропная форма существования элемента. Серо‑черный, с металлическим блеском, жирный на ощупь, мягкий, обладает электропроводимостью. Кристаллическая решетка состоит из слоев правильных шестиугольных колец, конденсированных по всем сторонам за счет оя‑связей (вр2‑гибридизация). Реагирует с водяным паром, кислотами‑окислителями. Типичный восстановитель при сплавлении, реагирует с кислородом, оксидами металлов и солями. Восстанавливается водородом и металлами.
Для графита характерно образование множества карбидов – солеобразных (СаС2, Al4С3), ковалентных (карборунд SiC), металлоподобных (имеющих нестехиометрический состав, например цементит Fe3C). Солеобразные карбиды полностью гидролизуются в воде.
Применяется как конструкционный материал, основа угольных электродов, замедлитель нейтронов в ядерных реакторах, кокс – восстановитель в металлургии и химической технологии, сажа – наполнитель резины.
Алмаз содержит в узлах кристаллической решетки атомы С с тетраэдрическим окружением (sр3‑гибридизация, р 3,52 г/см3). Благородный камень, имеет наибольшую твердость среди природных веществ. Химическая активность ниже, чем у графита. Выше 1200 °C переходит в графит. В чистом состоянии алмазы – прозрачные бесцветные кристаллы с сильным преломляющим эффектом. После обработки природных алмазов (огранка, шлифовка) получают ювелирные драгоценные камни – бриллианты. Менее чистые алмазы обычно окрашенные и мутные, например серо‑голубой и черный (карбонадо).
В промышленности из графита при 2000 °C под очень высоким давлением получают мелкие кристаллы искусственных алмазов. Применяются они для изготовления режущих инструментов и точных измерительных приборов.
Карбин состоит из линейных макромолекул (С2)nсо строением –C≡C– или =C=C= (sр‑гибридизация, ρ 3,27 г/см3). Химически менее активен, чем графит. При 2300 °C переходит в графит. Прозрачен и бесцветен, полупроводник. Широкого применения не имеет, очень редко встречается в природе.
Фуллерен состоит из молекул C60 или C70 (полые сферы; sр2‑гибридизация, ρ 1,7 г/см3, температура плавления 500–600 °C для С60), термически устойчив до 900– 1000 °C.
Темноокрашенный порошок, растворим в гексане (темно‑красный раствор для С60 темно‑оранжевый для С70), полупроводник. Химические свойства изучены мало. Получают фуллерен, испаряя графит в атмосфере гелия при пониженном давлении. Обнаружен в природе. Возможное использование в будущем – основа сверхпроводящих материалов.
Ниже рассматриваются свойства графита как самой распространенной и химически активной формы углерода.
Уравнения важнейших реакций:
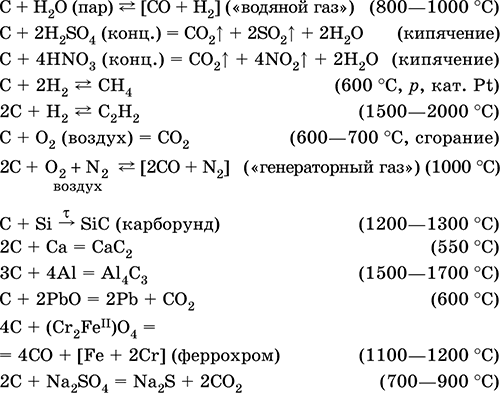
Получение: искусственные формы графита – кокс и сажа образуются при пиролизе каменного угля и углеводородов.
Дата публикования: 2014-11-04; Прочитано: 1989 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
