 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Оксиды азота. Азотная кислота
|
|
Монооксид азота NO. Несолеобразующий оксид. Бесцветный газ. Радикал, содержит ковалентную σπ‑связь (N=O), в твердом состоянии димер N2O2 со связью N – N. Чрезвычайно термически устойчив. Чувствителен к кислороду воздуха (буреет). Мало растворим в воде и не реагирует с ней. Химически пассивен по отношению к кислотам и щелочам. При нагревании реагирует с металлами и неметаллами. Весьма реакционноспособна смесь NO и NO2 («нитрозные газы»). Промежуточный продукт в синтезе азотной кислоты.
Уравнения важнейших реакций:
2NO + O2 (изб.) = 2NO2 (20 °C)
2NO + С (графит) = N2 + СO2 (400–500 °C)
lONO + 4Р (красн.) = 5N2 + 2Р2O5 (150–200 °C)
2NO + 4Cu = N2 + 2Cu2O (500–600 °C)
Реакции смеси NO и NO2:
NO + NO2 + Н2O = 2HNO2(p)
NO + NO2 + 2KOH (разб.) = 2KNO2 + H2O
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 (450–500 °C)
Получение: в промышленности – окисление аммиака (см.) кислородом на катализаторе, в лаборатории – взаимодействие разбавленной азотной кислоты с восстановителями:
8HNO3 (хол.) + 6Hg = 3Hg2(NO3)2 + 2 NO ↑ + 4Н2O
или восстановление нитритов:
2NaNO2 + 2H2SO4 (разб.) + 2NaI = 2 NO ↑ + I2↓ + 2H2O + 2Na2SO4
Диоксид азота NO2. Кислотный оксид, условно отвечает двум кислотам – HNO2 и HNO3 (кислота для NIV не существует). Бурый газ, при комнатной температуре мономер NO2, на холоду жидкий бесцветный димер N2O4 (тетраоксид диазота). Молекула NO2 – радикал со строением незавершенного треугольника [‑N(O)2] (sр2‑гибридизация) с ковалентными σ, π‑связями N=O. Молекула N2O4 содержит очень длинную связь N – N (175 пм), которая легко разрывается при температуре выше комнатной (в интервале 20,7–135,0 °C). Полностью реагирует с водой, щелочами. Очень сильный окислитель, вызывает коррозию металлов. Усиливает химическую активность NO (см.). Применяется для синтеза азотной кислоты и безводных нитратов, как окислитель ракетного топлива, очиститель нефти от серы и катализатор окисления органических соединений. Ядовит. Уравнения важнейших реакций:

Получение: в промышленности – окисление NO (см.) кислородом воздуха, в лаборатории – взаимодействие концентрированной азотной кислоты с восстановителями:
6HNO3 (конц., гор.) + S = H2SO4 + 6NO2↑ + 2Н2O
5HNO3 (конц., гор.) + Р (красн.) = Н3РO4 + 5NO2↑ + Н2O
2HNO3 (конц., гор.) + SO2 = H2SO4 + 2NO2↑
Оксид диазота N2O. Бесцветный газ с приятным запахом («веселящий газ»), N=N=O, формальная степень окисления азота +I, плохо растворим в воде. Поддерживает горение графита и магния:
2N2O + С = СO2 + 2N2 (450 °C)
N2O + Mg = N2 + MgO (500 °C)
Получают термическим разложением нитрата аммония:
NH4NO3 = N2O + 2Н2O (195–245 °C)
Применяется в медицине как анестезирующее средство.
Триоксид диазота N2O3. При низких температурах – синяя жидкость, ON=NO2, формальная степень окисления азота +III. При 20 °C на 90 % разлагается на смесь бесцветного NO и бурого NO2 («нитрозные газы», промышленный дым – «лисий хвост»). N2O3 – кислотный оксид, на холоду с водой образует HNO2, при нагревании реагирует иначе:
3N2O3 + Н2O = 2HNO3 + 4NO↑
Со щелочами дает соли HNO2, например NaNO2.
Получают взаимодействием NO с O2 (4NO + 3O2 = 2N2O3) или с NO2 (NO + NO2 = N2O3) при сильном охлаждении. «Нитрозные газы» ядовиты и экологически опасны, действуют как катализаторы разрушения озонового слоя атмосферы.
Пентаоксид диазота N2O5. Бесцветное твердое вещество, O2N – О–NO2, степень окисления азота +V. При комнатной температуре за 10 ч разлагается на NO2 и O2. Реагирует с водой и щелочами как кислотный оксид:
N2O5 + Н2O = 2HNO3
N2O5 + 2NaOH = 2NaNO3 + H2O
Получают дегидратацией дымящей азотной кислоты:
2HNO3 + Р2O5 = N2O5 + 2НРO3
или окислением NO2 озоном при ‑78 °C:
2NO2 + O3 = N2O5 + O2
Азотная кислота HNO3. Оксокислота. Бесцветная жидкость. Молекула имеет искаженно‑треугольное строение [N(O)2(OH)] (sp2– гибридизация), содержит ковалентные σπ‑связи N=O и о‑связь N – ОН. Разлагается при стоянии на свету (желтеет). Хорошо растворяет оксиды азота (красно‑бурая «дымящая» кислота, плотность 1,56 г/мл). Неограниченно смешивается с водой, перегоняется при обычных условиях в виде азеотропной смеси (массовая доля кислоты 68,4 %, плотность 1,41 г/мл, температура кипения 120,7 °C), образует гидрат HNO3 Н2O (точнее, H3NO4 – ортоазотная кислота).
Сильная кислота в растворе, ион NO3‑ имеет строение правильного треугольника (sр2‑гибридизация). Нейтрализуется щелочами и гидратом аммиака. Реагирует с основными и амфотерными оксидами и гидроксидами, вытесняет слабые кислоты из их солей. Сильный окислитель в концентрированном растворе (за счет Nv). Образует смесь продуктов восстановления азота – от NIVO2 до N‑IIIН4+, в зависимости от концентрации кислоты и силы восстановителя в этой смеси преобладают разные продукты (условно для концентрированной кислоты указывают NO2, для разбавленной – NO, для очень разбавленной – NH4+).
Концентрированная кислота пассивирует Al, Be, Bi, Со, Cr, Fe, Ni и Pb, не реагирует с Au и Pt. Смесь HNO3 (конц.) и НCl (конц.) – «царская водка» – обладает еще более сильным окислительным действием: переводит в раствор золото и платину. Нитрующим началом HNO3 в ее реакциях с органическими веществами является ион NO2+ (нитроил).
В отличие от самой кислоты HNO3 ее соли – нитраты проявляют сильные окислительные свойства только при сплавлении за счет выделяющегося кислорода. При нагревании нитраты разлагаются по‑разному, в зависимости от положения металла в ряду напряжений:


Применяется азотная кислота для производства минеральных удобрений, взрывчатых веществ, нитратов металлов, органических нитропроизводных, искусственных волокон и пластмасс, красителей, лекарственных препаратов.
Уравнения важнейших реакций:
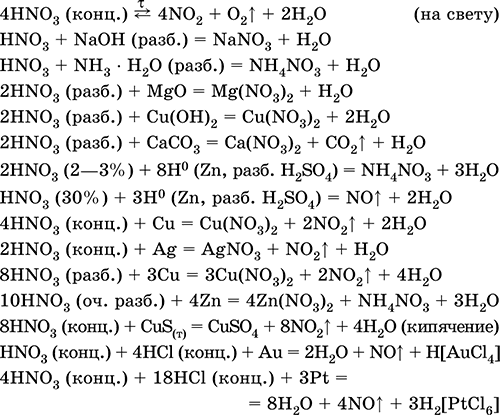
Получение: промышленный синтез состоит из следующих этапов:
N2 + Н2 → NH3 → NO → NO2 → HNO3→ HNO3,
а именно: производство аммиака (см.), каталитическое окисление аммиака (см.) до NO, перевод NO (см.) в NO2, поглощение смеси NO2 и O2 водой (см.).
Дата публикования: 2014-11-04; Прочитано: 4835 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
