 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Азот. Аммиак
|
|
Азот – элемент 2‑го периода и VA‑группы Периодической системы, порядковый номер 7. Электронная формула атома [2He]2s22p3, характерные степени окисления 0, ‑III, +III и +V, реже +II, +IV и др.; состояние Nv считается относительно устойчивым.
Шкала степеней окисления азота:
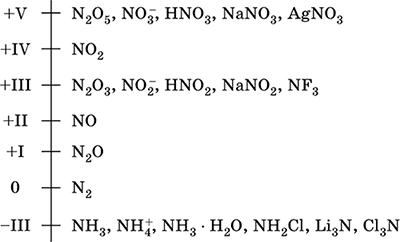
Азот обладает высокой электроотрицательностью (3,07), третий после F и О. Проявляет типичные неметаллические (кислотные) свойства. Образует различные кислородсодержащие кислоты, соли и бинарные соединения, а также катион аммония NH4+ и его соли.
В природе – семнадцатый по химической распространенности элемент (девятый среди неметаллов). Жизненно важный элемент для всех организмов.
Азот N2. Простое вещество. Состоит из неполярных молекул с очень устойчивой σππ‑связью N ≡ N, этим объясняется химическая инертность азота при обычных условиях. Бесцветный газ без вкуса и запаха, конденсируется в бесцветную жидкость (в отличие от O2).
Главная составная часть воздуха: 78,09 % по объему, 75,52 % по массе. Из жидкого воздуха азот выкипает раньше кислорода O2. Малорастворим в воде (15,4 мл/1 л Н2O при 20 °C), растворимость азота меньше, чем у кислорода.
При комнатной температуре N2 реагирует только с литием (во влажной атмосфере), образуя нитрид лития Li3N, нитриды других элементов синтезируют при сильном нагревании:
N2 + 3Mg = Mg3N2 (800 °C)
В электрическом разряде N2 реагирует с фтором и в очень малой степени – с кислородом:

Обратимая реакция получения аммиака протекает при 500 °C, под давлением до 350 атм и обязательно в присутствии катализатора (Fe/F2O3/FeO, в лаборатории Pt):
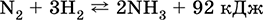
В соответствии с принципом Ле‑Шателье увеличение выхода аммиака должно происходить при повышении давления и понижении температуры. Однако скорость реакции при низких температурах очень мала, поэтому процесс ведут при 450–500 °C, достигая 15 %‑ного выхода аммиака. Непрореагировавшие N2 и Н2 возвращают в реактор и тем самым увеличивают степень протекания реакции.
Азот химически пассивен по отношению к кислотам и щелочам, не поддерживает горения.
Получение в промышленности – фракционная дистилляция жидкого воздуха или удаление из воздуха кислорода химическим путем, например по реакции 2С (кокс) + O2 = 2СО при нагревании. В этих случаях получают азот, содержащий также примеси благородных газов (главным образом аргон).
В лаборатории небольшие количества химически чистого азота можно получить по реакции конмутации при умеренном нагревании:
N‑IIIH4NIIIO2(т) = N20 + 2H2O (60–70 °C)
NH4Cl(p) + KNO2(p) = N20↑ + KCl + 2H2O (100 °C)
Применяется для синтеза аммиака, азотной кислоты и других азотсодержащих продуктов, как инертная среда проведения химических и металлургических процессов и хранения огнеопасных веществ.
Аммиак NH3. Бинарное соединение, степень окисления азота равна – III. Бесцветный газ с резким характерным запахом. Молекула имеет строение незавершенного тетраэдра [: N(H)3)] (sр3‑гибридизация). Наличие у азота в молекуле NH3донорной пары электронов на sр3‑гибридной орбитали обусловливает характерную реакцию присоединения катиона водорода, при этом образуется катион аммония NH4+. Сжижается под избыточным давлением при комнатной температуре. В жидком состоянии ассоциирован за счет водородных связей. Термически неустойчив. Хорошо растворим в воде (более 700 л/1 л Н2O при 20 °C); доля в насыщенном растворе равна = 34 % по массе и = 99 % по объему, рН = 11,8.
Весьма реакционноспособный, склонен к реакциям присоединения. Crорает в кислороде, реагирует с кислотами. Проявляет восстановительные (за счет N‑III) и окислительные (за счет НI) свойства. Осушается только оксидом кальция.
Качественные реакции – образование белого «дыма» при контакте с газообразным НCl, почернение бумажки, смоченной раствором Hg2(NO3)2.
Промежуточный продукт при синтезе HNO3 и солей аммония. Применяется в производстве соды, азотных удобрений, красителей, взрывчатых веществ; жидкий аммиак – хладагент. Ядовит.
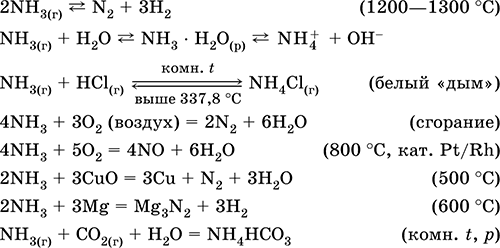
Уравнения важнейших реакций:
Получение: в лаборатории – вытеснение аммиака из солей аммония при нагревании с натронной известью (NaOH + СаО):
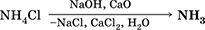
или кипячение водного раствора аммиака с последующим осушением газа.
В промышленности аммиак синтезируют из азота (см.) с водородом. Выпускается промышленностью либо в сжиженном виде, либо в виде концентрированного водного раствора под техническим названием аммиачная вода.
Гидрат аммиака NH3 Н2O. Межмолекулярное соединение. Белый, в кристаллической решетке – молекулы NH3и Н2O, связанные слабой водородной связью H3N… НОН. Присутствует в водном растворе аммиака, слабое основание (продукты диссоциации – катион NH4‑ и анион ОН‑). Катион аммония имеет правильно‑тетраэдрическое строение (sp3‑гибридизация). Термически неустойчив, полностью разлагается при кипячении раствора. Нейтрализуется сильными кислотами. Проявляет восстановительные свойства (за счет NIII) в концентрированном растворе. Вступает в реакции ионного обмена и комплексообразования.
Качественная реакция – образование белого «дыма» при контакте с газообразным НCl.
Применяется для создания слабощелочной среды в растворе, при осаждении амфотерных гидроксидов.
В 1М растворе аммиака содержится в основном гидрат NH3 Н2O и лишь 0,4 % ионов NH4+ и ОН‑ (за счет диссоциации гидрата); таким образом, ионный «гидроксид аммония NH4OH» практически не содержится в растворе, нет такого соединения и в твердом гидрате. Уравнения важнейших реакций:
NH3 Н2O (конц.) = NH3↑ + Н2O (кипячение с NaOH)
NH3 Н2O + НCl (разб.) = NH4Cl + Н2O
3(NH3 Н2O) (конц.) + CrCl3 = Cr(OH)3↓ + 3NH4Cl
8(NH3 Н2O) (конц.) + ЗBr2(р) = N2↑ + 6NH4Br + 8Н2O (40–50 °C)
2(NH3 Н2O) (конц.) + 2КMnO4 = N2↑ + 2MnO2↓ + 4Н2O + 2КОН
4(NH3 Н2O) (конц.) + Ag2O = 2[Ag(NH3)2]OH + 3H2O
4(NH3 Н2O) (конц.) + Cu(OH)2 + [Cu(NH3)4](OH)2 + 4Н2O
6(NH3 Н2O) (конц.) + NiCl2 = [Ni(NH3)6]Cl2 + 6Н2O
Разбавленный раствор аммиака (3–10 %‑ный) часто называют нашатырным спиртом (название придумано алхимиками), а концентрированный раствор (18,5–25 %‑ный) – аммиачной водой (выпускается промышленностью).
Дата публикования: 2014-11-04; Прочитано: 3187 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
