 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Серная кислота. Сульфаты
|
|
Серная кислота H2SO4. Оксокислота. Бесцветная жидкость, очень вязкая (маслообразная), весьма гигроскопичная. Молекула имеет искаженно‑тетраэдрическое строение [S(O)2(OH)2] (sр3‑гибридизация), содержит ковалентные σ‑связи S – ОН и σπ‑связи S=O. Ион SO42‑ имеет правильно‑тетраэдрическое строение [S(O)4]. Обладает широким температурным интервалом жидкого состояния (~300 градусов). При нагревании выше 296 °C частично разлагается. Перегоняется в виде азеотропной смеси с водой (массовая доля кислоты 98,3 %, температура кипения 296–340 °C), при более сильном нагревании разлагается полностью. Неограниченно смешивается с водой (с сильным экзо ‑эффектом). Сильная кислота в растворе, нейтрализуется щелочами и гидратом аммиака. Переводит металлы в сульфаты (при избытке концентрированной кислоты в обычных условиях образуются растворимые гидросульфаты), но металлы Be, Bi, Со, Fe, Mg и Nb пассивируются в концентрированной кислоте и не реагируют с ней. Реагирует с основными оксидами и гидроксидами, разлагает соли слабых кислот. Слабый окислитель в разбавленном растворе (за счет НI), сильный – в концентрированном растворе (за счет SVI). Хорошо растворяет SO3 и реагирует с ним (образуется тяжелая маслообразная жидкость – олеум, содержит H2S2O7).
Качественная реакция на ион SO42‑ – осаждение белого сульфата бария BaSO4 (осадок не переводится в раствор соляной и азотной кислотами, в отличие от белого осадка BaSO3).
Применяется в производстве сульфатов и других соединений серы, минеральных удобрений, взрывчатых веществ, красителей и лекарственных препаратов, в органическом синтезе, для «вскрытия» (первого этапа переработки) промышленно важных руд и минералов, при очистке нефтепродуктов, электролизе воды, как электролит свинцовых аккумуляторов. Ядовита, вызывает ожоги кожи. Уравнения важнейших реакций:
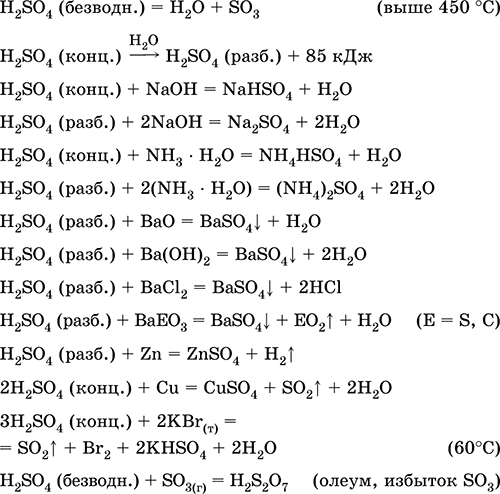
Получение в промышленности:
а) синтез SO2 из серы, сульфидных руд, сероводорода и сульфатных руд:
S + O2 (воздух) = SO2 (280–360 °C)
4FeS2 + 11O2 (воздух) = 8 SO2 + 2Fe2O3 (800 °C, обжиг)
2H2S + 3O2 (изб.) = 2 SO2 + 2Н2O (250–300 °C)
CaSO4 + С (кокс) = СаО + SO2 + СО (1300–1500 °C)
б) конверсия SO2 в SO3 в контактном аппарате:
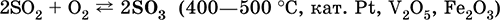
в) синтез концентрированной и безводной серной кислоты:
Н2O (разб. H2SO4) + SO3 = H2SO4 (конц., безводн.)
(поглощение SO3 чистой водой с получением H2SO4 не проводится из‑за сильного разогревания смеси и обратного разложения H2SO4, см. выше);
г) синтез олеума – смеси безводной H2SO4, дисерной кислоты H2S2O7 и избыточного SO3. Растворенный SO3 гарантирует безводность олеума (при попадании воды тут же образуется H2SO4), что позволяет безопасно перевозить его в стальных цистернах.
Сульфат натрия Na2SO4. Оксосоль. Белый, гигроскопичный. Плавится и кипит без разложения. Образует кристаллогидрат (минерал мирабилит), легко теряющий воду; техническое название глауберова соль. Хорошо растворим в воде, не гидролизуется. Реагирует с H2SO4 (конц.), SO3. Восстанавливается водородом, коксом при нагревании. Вступает в реакции ионного обмена.
Применяется в производстве стекла, целлюлозы и минеральных красок, как лекарственное средство. Содержится в рапе соляных озер, в частности в заливе Кара‑Богаз‑Гол Каспийского моря.
Уравнения важнейших реакций:

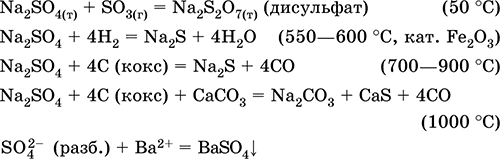
Гидросульфат калия KHSO4. Кислая оксосоль. Белый, гигроскопичный, но кристаллогидратов не образует. При нагревании плавится и разлагается. Хорошо растворим в воде, в растворе анион подвергается диссоциации, среда раствора сильнокислотная. Нейтрализуется щелочами.
Применяется как компонент флюсов в металлургии, составная часть минеральных удобрений.
Уравнения важнейших реакций:
2KHSO4 = K2SO4 + H2SO4 (до 240 °C)
2KHSO4 = K2S2O7 + Н2O (320–340 °C)
KHSO4 (разб.) + КОН (конц.) = K2SO4 + Н2O KHSO4 + КCl = K2SO4 + НCl (450–700 °C)
6KHSO4 + М2O3 = 2KM(SO4)2 + 2K2SO4 + 3H2O (350–500 °C, M = Al, Cr)
Получение: обработка сульфата калия концентрированной (более чем 6O%‑ной) серной кислотой на холоду:
K2SO4 + H2SO4 (конц.) = 2 KHSO4
Сульфат кальция CaSO4. Оксосоль. Белый, весьма гигроскопичный, тугоплавкий, при прокаливании разлагается. Природный CaSO4 встречается в виде очень распространенного минерала гипс CaSO4 2Н2O. При 130 °C гипс теряет часть воды и переходит в жжёный (штукатурный) гипс 2CaSO4 • Н2O (техническое название алебастр). Полностью обезвоженный (200 °C) гипс отвечает минералу ангидрит CaSO4. Малорастворим в воде (0,206 г/100 г Н2O при 20 °C), растворимость уменьшается при нагревании. Реагирует с H2SO4 (конц.). Восстанавливается коксом при сплавлении. Определяет большую часть «постоянной» жесткости пресной воды (подробнее см. 9.2).
Уравнения важнейших реакций: 100–128 °C
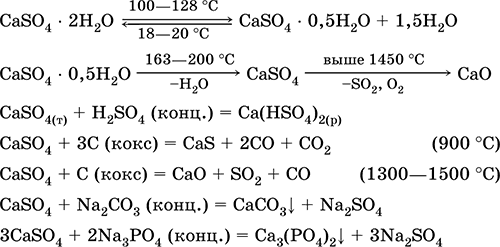
Применяется как сырье в производстве SO2, H2SO4 и (NH4)2SO4, как флюс в металлургии, наполнитель бумаги. Приготовленный из жженого гипса вяжущий строительный раствор «схватывается» быстрее, чем смесь на основе Са(ОН)2. Затвердевание обеспечивается связыванием воды, образованием гипса в виде каменной массы. Используется жженый гипс для изготовления гипсовых слепков, архитектурно‑декоративных форм и изделий, перегородочных плит и панелей, каменных полов.
Сульфат алюминия‑калия KAl(SO4)2. Двойная оксосоль. Белый, гигроскопичный. При сильном нагревании разлагается. Образует кристаллогидрат – алюжокалиевые квасцы. Умеренно растворим в воде, гидролизуется по катиону алюминия. Реагирует со щелочами, гидратом аммиака.
Применяется как протрава при крашении тканей, дубитель кож, коагулянт при очистке пресной воды, компонент составов для проклеивания бумаги, наружное кровоостанавливающее средство в медицине и косметологии. Образуется при совместной кристаллизации сульфатов алюминия и калия.
Уравнения важнейших реакций:
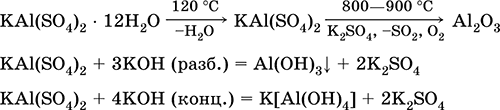
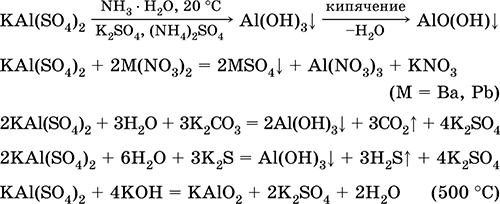
Сульфат хрома(III) – калия KCr(SO4)2. Двойная оксосоль. Красный (гидрат темно‑фиолетовый, техническое название хрожокалиевые квасцы). При нагревании разлагается без плавления. Хорошо растворим в воде (серо‑синяя окраска раствора отвечает аквакомплексу [Cr(Н2O)6]3+), гидролизуется по катиону хрома(III). Реагирует со щелочами, гидратом аммиака. Слабый окислитель и восстановитель. Вступает в реакции ионного обмена.
Качественные реакции на ион Cr3+ – восстановление до Cr2+ или окисление до желтого CrO42‑.
Применяется как дубитель кож, протрава при крашении тканей, реактив в фотографии. Образуется при совместной кристаллизации сульфатов хрома(III) и калия. Уравнения важнейших реакций:
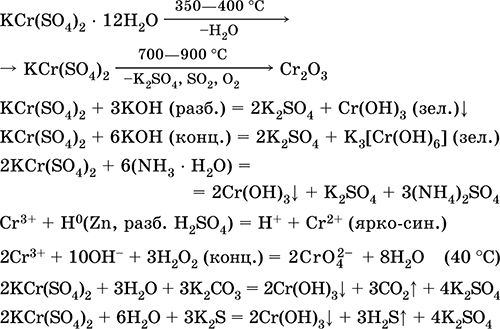
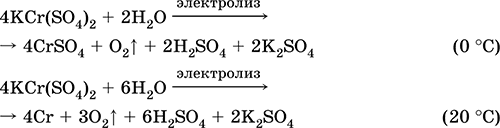
Сульфат марганца (II) MnSO4. Оксосоль. Белый, при прокаливании плавится и разлагается. Кристаллогидрат MnSO4 5Н2O – красно‑розовый, техническое название марганцевый купорос. Хорошо растворим в воде, светло‑розовая (почти бесцветная) окраска раствора отвечает аквакомплексу [Mn(Н2O)6]2+; гидролизуется по катиону. Реагирует со щелочами, гидратом аммиака. Слабый восстановитель, реагирует с типичными (сильными) окислителями.
Качественные реакции на ион Mn2+ – конмутация с ионом MnO4 и исчезновение фиолетовой окраски последнего, окисление Mn2+ до MnO4 и появление фиолетовой окраски.
Применяется для получения Mn, MnO2 и других соединений марганца, как микроудобрение и аналитический реагент.
Уравнения важнейших реакций:
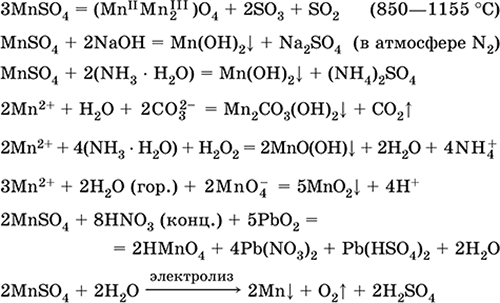
Получение:
2MnO2 + 2H2SO4 (конц.) = 2 MnSO4 + O2↑ + 2H2O (100 °C)
Сульфат железа (II) FeSO4. Оксосоль. Белый (гидрат светло‑зеленый, техническое название железный купорос), гигроскопичный. Разлагается при нагревании. Хорошо растворим в воде, в малой степени гидролизуется по катиону. Быстро окисляется в растворе кислородом воздуха (раствор желтеет и мутнеет). Реагирует с кислотами‑окислителями, щелочами, гидратом аммиака. Типичный восстановитель.
Применяется как компонент минеральных красок, электролитов в гальванотехнике, консервант древесины, фунгицид, лекарственное средство против анемии. В лаборатории чаще берется в виде двойной соли Fe(NH4)2(SO4)2 6Н2O (соль Мора), более устойчивой к действию воздуха.
Уравнения важнейших реакций:
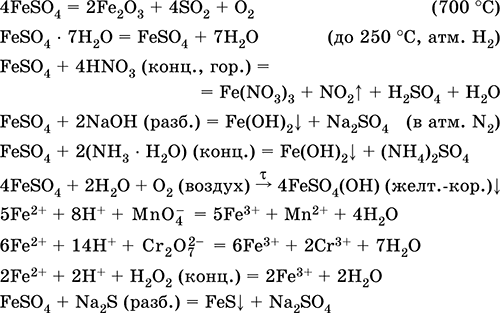
Получение:
Fe + H2SO4 (разб.) = FeSO4 + H2↑
FeCO3 + H2SO4 (разб.) = FeSO4 + CO2↑ + H2O
7.4. Неметаллы VA‑группы
Дата публикования: 2014-11-04; Прочитано: 3769 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
