 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Удаление аммиака из организма. Орнитиновый цикл
|
|
Аммиак очень токсичное соединение, особенно для нервных клеток. При накоплении его возникает возбуждение нервной системы. Поэтому концентрация аммиака в организме должна сохраняться на низком уровне. Уровень аммиака в норме в крови не превышает 1-2 мг/л (это почти в 1000 раз меньше концентрации сахара в крови). На кроликах показано, что концентрация аммиака 50 мг/л является летальной. Таким образом, аммиак должен подвергаться связыванию в тканях с образованием нетоксичных соединений, легко выделяемых с мочой.
Аммиак образуется в ходе следующих процессов:
- дезаминирование аминокислот;
- дезаминирование биогенных аминов;
- дезаминирование пуриновых оснований (гуанина и аденина);
- дезаминирование глутамина и аспарагина;
- распад пиримидиновых оснований (урацила, тимина, цитозина). В тканях организма существуют следующие пути обезвреживания аммиака:
- образование мочевины (орнитиновый цикл);
- восстановительное аминирование кетокислот;
- образование амидов аминокислот - аспарагина и глутамина;
- образование аммонийных солей.
Главный путь обезвреживания аммиака - синтез мочевины, происходящий в печени.
В 1933 году Кребс и Гензелейт установили, что синтез мочевины представляет собой циклический процесс, в котором каталитическую роль играет орнитин. В последующие десятилетия были раскрыты все реакции этого процесса, и он получил название орнитинового цикла, или цикла Кребса-Гензелейта (рис. 39).

Рис. 39. Орнитиновый цикл мочевинобразования
Начальной реакцией этого цикла является синтез высокоэнергетического соединения - карбамоилфосфата под действием фермента - карбамоилфосфатсинтетазы:

Карбамоильная группа далее переносится на орнитин с образованием цитруллина; реакцию катализирует орнитин-карбамоилтрансфераза:

| Орнитин | Карбамоилфосфат | Цитруллин |
Затем цитруллин- реагирует с аспарагиновой кислотой, превращаясь в аргининянтарную кислоту при действии аргининосукцинатсинтетазы:

| Цитруллин | Аспартат | Аргининосукцинат |
Аргининосукцинат под действием аргининосукциназы распадается на аргинин и фумаровую кислоту:
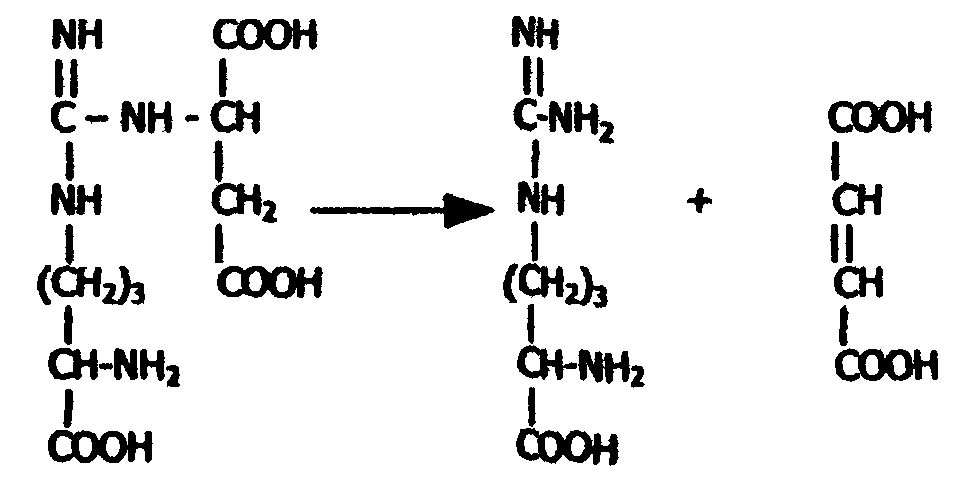
| Аргининосукцинат | Аргинин | Фумарат |
Далее аргинин гидролизуется аргиназой с образованием мочевины и орнитина:
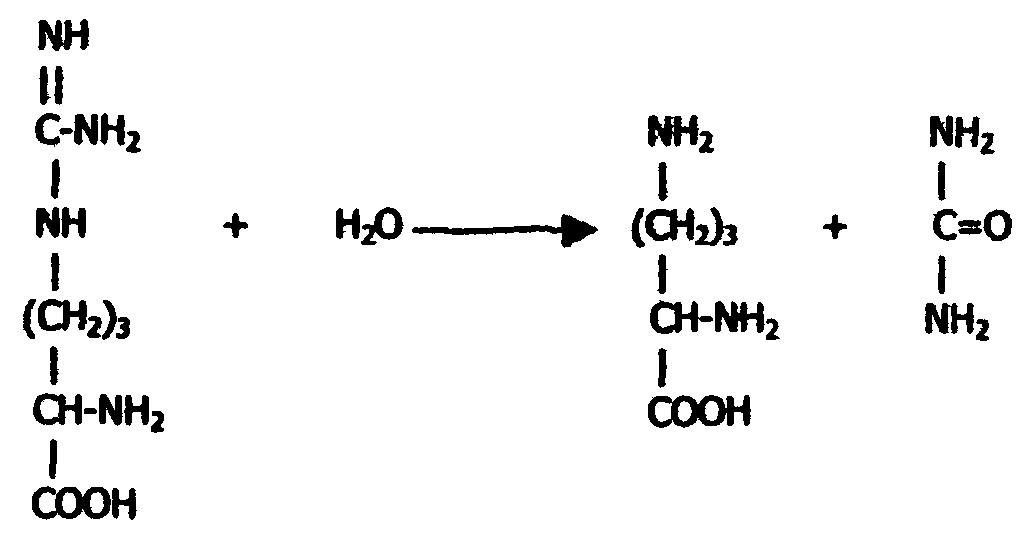
| Аргинин | Орнитин | Мочевина |
Мочевина поступает с током крови а почки и уносится из организма с мочой, а орнитин возвращается в цикл. Реакции орнитинового цикла до стадии образования цитруллина происходят в митохондриях, а последующие стадии - в цитозоле клеток. Если человек в сутки получает 80-100 г белков, то образуется 25-30 г мочевины.
Важным вспомогательным путем связывания аммиака является образование аспарагина и глутамина с участием аспарагинсинтетазы и глутаминсинтетазы соответственно:
аспартат + АТФ + NH3 = аспарагин + АМФ + Н4Р2О7;
глутамат + АТФ + NH3 = глутамин + АДФ + H3PО4.
Эти процессы активны в нервной и мышечной тканях, в почках, в печени.
Часть аммиака легко связывается с α-кетоглутаровой кислотой, т.е. протекает реакция, обратная окислительному дезаминированию глутаминовой кислоты:
α-кетоглутарат + NH3 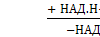 глутамат + Н2О
глутамат + Н2О
Но вклад этой реакции в обезвреживание аммиака невелик, так как необходимы значительные количества α-кетоглутарата.
Глутамин и в меньшей степени аспарагин считают как бы транспортной формой аммиака, так как, образуясь в тканях, они с кровью попадают в почки, где подвергаются гидролизу под действием специфических ферментов - глутаминазы и аспарагиназы:
аспарагин + Н2О = аспартат + NH3;
глутамин + H2O = глутамат + NH3.
Освободившийся в канальцах почек аммиак нейтрализует кислые продукты обмена при ацидозе, защищая тем самым организм от потери с мочой ионов Na+ и К*. При этом образуются соли аммония:
NH3 + Н+ + СI¯ = NH4CI,
которые выделяются с мочой.
Дата публикования: 2015-11-01; Прочитано: 2070 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
