 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Свойства галогенидов лития
|
|
| Соединение | Т пл.,ºC | Т кип.,ºC | – ΔH 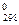 , кДж/моль , кДж/моль
| d, г/см3 |
| LiF | 2,2 | |||
| LiCl | 2,07 | |||
| LiBr | 2,9 | |||
| LiJ | 3,3 |
При нагревании гидрофторид разлагается на LiF и HF. В отличие от других галогенидов лития LiF не растворяется в большинстве органических растворителей. Фторид лития образует двойные соединения с фторидами многих элементов. Для получения LiF используют реакцию взаимодействия Li2CO3 с плавиковой кислотой или осаждение из растворов солей лития фторидами калия, натрия, аммония.
Незначительная растворимость LiF в воде используется в аналитической химии для отделения лития от других щелочных металлов. Предлагалось использовать LiF для выделения лития из разбавленных производственных растворов после первичного осаждения Li2CO3. Фторид лития применяется в качестве компонента многих флюсов, используемых при плавке металлов и при получении алюминия в бокситкриолитовых ваннах. Монокристаллы LiF применяются (вместо CaCl2) в оптических приборах, тат как они прозрачны для лучей с длиной волны до 1000Ǻ и имеют практически постоянную дисперсию в пределах всего видимого спектра.
|
 |
Хлорид лития, LiCl, – бесцветное вещество, кристаллизующееся в ГЦК – решетке типа NaCl (a = 5,1398 Å), плотность 2,07 г/см3, температура плавления 607 ºC, энтальпия образования – 405 кДж/моль (табл. 3). Выше 880 ºC LiCl заметно испаряется. Хлорид лития, в отличие от NaCl и KCl, гигроскопичен, на воздухе расплывается сильнее CaCl2, хорошо растворяется в воде. Растворимость LiCl (20ºC) составляет 80,6 г/100г H2O, с повышением температуры растворимость увеличивается. Из водных растворов LiCl выделяется в виде кристаллогидратов (подобно MgCl2, CaCl2) (рис. 6).
Как видно из рис. 6, система LiCl – H2O характеризуется следующими температурами фазовых переходов:
94ºC LiCl↔LiCl∙H2O
190 ºC LiCl∙H2O↔LiCl∙2H2O
–20,5ºC LiCl∙2H2O↔LiCl∙3H2O
–65,6ºC LiCl∙3H2O↔LiCl∙5H2O
Эвтектическая точка 25 масс.% LiCl и –75,9 ºC. В водных растворах LiCl сильно диссоциирован, в 1М растворе степень диссоциации 84,1%, а в 0,002М – 97%. Хлорид лития хорошо растворяется во многих органических растворителях – спиртах, в том числе многоатомных, хлороформе, ацетоне, пиридине, сложных эфирах. Растворение часто сопровождается разогреванием вследствие образования сольватов (LiCl∙CH3OH).
Вследствие способности ионов Li+ к гидратации хлорид лития является энергичным высаливающим и дегидратирующим агентом. Сухой LiCl и его растворы поглощают аммиак, образуя комплексные ионы [Li(NH3)4]+. LiCl образует двойные соединения с хлоридами многих элементов.
Хлорид лития получается хлорированием металлического лития, Li2O или LiOH хлором или газообразным HCl или по реакции:
Li2SO4 + BaCl2↔LiCl + BaSO4 (12)
В промышленном масштабе используется реакция
Li2CO3 + HCl → 2LiCl + H2O + CO2 (13)
Хлорид лития имеет важное промышленное значение, так как является практически единственным соединением, используемым для получения металлического лития. Способность LiCl и его растворов поглощать аммиак и обратимо поглощать пары воды при изменении температуры и влажности окружающего воздуха определили применение LiCl для кондиционирования воздуха в производственных помещениях и общественных зданиях.
Бромид лития, LiBr, – бесцветное кристаллическое вещество с кубической гранецентрированной решеткой типа NaCl (a = 5,501 Ǻ), плотность 3,464 г/см3, Т пл. 552 ºC; энтальпия образования ΔH = – 349 кДж/моль (табл. 3). Выше температуры плавления начинает разлагаться. Расплавленный LiBr разрушает стекло, фарфор и платину. Бромид лития более гигроскопичен, чем LiCl и лучше, чем LiCl, растворяется в воде (при 20 ºC – 177 г/100 г H2O). Из водных растворов выделяется в виде кристаллогидратов с 2, 3 и 5 молекулами воды; обезвоживается с трудом. Бромид лития растворяется в спиртах, ацетоне, пиридине, глицерине и других органических растворителях, взаимодействует с аммиаком с образованием соединения LiBr∙nNH3 (n = 1÷4). Получают LiBr при непосредственном взаимодействии элементов, реакция протекает менее энергично, чем между литием и хлором. В промышленности используют реакцию Li2CO3 с бромисто-водородной кислотой. Монокристаллы бромида лития используются в оптике.
Иодид лития, LiI, – кристаллическое вещество, как и остальные галогениды лития, имеет кристаллическую решетку типа NaCl (ГЦК; a = 6,012Ǻ). Самый неустойчивый галогенид лития, имеет самую низкую энтальпию образования (– 271 кДж/моль), а также температуры плавления и кипения (табл. 3). Расплавленный LiI разрушает стекло, фарфор, платину, очень гигроскопичен, хорошо растворяется в воде (при 19ºC – 164 г/100г H2O). Из водных растворов выделяется в виде кристаллогидратов с 0,5; 1; 2 и 3 молекулами воды. Обезвоживается при нагревании в токе HI, при пропускании через расплавленную соль сухого водорода или возгонкой в вакууме. Растворяется в спиртах, пиридине, с аммиаком образует продукты присоединения LiI∙nNH3 (n = 1÷7). При взаимодействии расплавленного LiI с I2 образуются полигалогениды LiIn (n = 3÷9). При добавлении в раствор LiI соляной, азотной или серной кислоты выделяется иод. Получают LiI по реакции между Li2CO3 и HI с последующим упариванием и высушиванием образующегося кристаллогидрата в токе HI и удалением иода путем пропускания через расплавленную соль водорода. Иодид лития применяется в медицине и в производстве фотореактивов, в виде раствора с иодидом ртути (“тяжелые жидкости”) используется для разделения минералов.
Литий образует соли со всеми кислородсодержащими кислотами хлора: LiCl+1O (гипохлорит), LiCl+3O2 (хлорит), LiCl+5O3 (хлорат), LiCl+7O4 (перхлорат). Все эти соли – сильные окислители, из них наиболее устойчив перхлорат, Тпл. которого 236 ºC; выше 400 ºC разлагается на LiCl и O2. LiClO4 гигроскопичен, хорошо растворяется в воде, спиртах, эфирах.
Для брома и иода известны только отдельные представители соединений этого типа. Наиболее интересным из них является иодат лития LiIO3, обладающий уникальным комплексом свойств – акустических, пьезоэлектрических.
Дата публикования: 2015-10-09; Прочитано: 3057 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
