 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Свойства гидроксидов щелочных металлов
|
|
| Гидроксид | T пл., ºС | T кип., ºС | Растворимость в воде, г /100 г H2O | ΔH 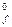 ,кДж/моль ,кДж/моль
| |
| 15 ºС | 100 ºС | ||||
| LiOH | 924* | - 484,7 | |||
| NaOH | - 426,3 | ||||
| KOH | - 424,7 | ||||
| RbOH | - 418,4 | ||||
| CsOH | очень высокая | - 417,1 |
|
2LiOH → Li2O + H2O (4)
Для LiOH характерна более низкая по сравнению с гидроксидами других щелочных элементов растворимость в воде, которая увеличивается с повышением температуры (рис. 1), из водных растворов выделяется в виде моногидрата, LiOH∙H2O, который теряет кристаллизационную воду только выше 600 ºС. Гидрат гидроксида лития LiOH∙H2O в твердом виде состоит из димеров Li2(OH)2, связанных в цепочки мостиковыми молекулами воды (рис. 2). Сходные димеры преобладают и в парах LiOH при 800 ºС. При обычной температуре гидроксид лития и его концентрированные растворы разрушают стекло и фарфор, в расплавленном состоянии разрушают все металлы, кроме Au, Ag и Ni. Гидроксид лития образуется при непосредственном взаимодействии металлического лития или его оксида с водой, а также при гидролизе сульфида, нитрида, фосфидов и других соединений лития.
|

|

На практике для получения LiOH используют несколько методов.
1. Методы, основанные на реакциях обмена в растворе:
Li2SO4 + Ca(OH)2 → 2LiOH + CaSO4 (5)
Li2SO4 + Ba(OH)2 → 2LiOH + BaSO4 (6)
2. Электролиз LiCl. Раствор LiCl подвергают электролизу в ванне с ртутным катодом; при этом на нем образуется амальгама лития, LiHg. При разложении амальгамы водой получают раствор LiOH.
3. Обменное разложение гашеной известью в растворе:
Li2CO3 + Ca(OH)2 → 2LiOH + CaCO3 (7)
Этот метод имеет промышленное значение.
Сульфат лития, Li2SO4, – бесцветное кристаллическое вещество, существует в трех модификациях: моноклинная α-модификация (a = 8,44; b = 4,95; c = 8,24 Ǻ, β = 107º 54') устойчива до 500 ºC; выше 500 ºC переходит в гексагональную β-модификацию, которая при 575 ºС переходит в кубическую γ-модификацию, существующую до температуры плавления. Плотность α-Li2SO4 (25 ºC) – 2,22 г/см3.

Энтальпия образования ΔH = –1434 кДж/моль; Li2SO4 хорошо растворяется в воде (рис. 3), выше 0 ºC имеет отрицательный коэффициент растворимости, из водных растворов выделяется в виде моногидрата, Li2SO4∙H2O, который обезвоживается при 500ºC.
|
В органических растворителях Li2SO4 не растворяется, образует двойные соединения с сульфатами других щелочных металлов (MLiSO4; Na3Li(SO4)2∙6H2O и др.). В отличие от сульфатов других щелочных металлов в обычных температурных условиях не образует квасцов. Алюмо-литиевые квасцы (LiAl(SO4)2∙12H2O) существуют только в узкой области концентраций компонентов в системе Li2SO4 – Al2(SO4)3 – H2O при –2 ºC (и ниже).
Сульфат лития можно получить при взаимодействии H2SO4 с литием, Li2O или LiOH, но обычно его получают при взаимодействии Li2CO3 с H2SO4. Для лития известны также гидросульфаты и пиросульфат.
Нитрат лития, LiNO3, – бесцветное прозрачное кристаллическое вещество гексагональной сингонии (a = 4,674; c = 15,199 Ǻ), плотность 2,36 г/см3 (20 ºC), Т пл. = 254 ºC, энтальпия образования ΔH = – 428 кДж/моль, при 600 ºC начинает разлагаться с выделением кислорода и оксидов азота.
Нитрат лития гигроскопичен, хорошо растворяется в воде, растворимость резко увеличивается с повышением температуры (рис.4), образует пересыщенные растворы.
|

В водном растворе LiNO3 сильно диссоциирован, степень диссоциации в 0,1 М растворе 64 %, в 0,001 М растворе – 97,5 %. Из водных растворов ниже 30 ºC кристаллизуется LiNO3∙3H2O, при более высокой температуре – LiNO3.
Получают нитрат лития взаимодействием LiOH (Li2CO3) с разбавленной HNO3 с последующим упариванием раствора и нагреванием остатка в вакууме при 200 ºC.
Ортофосфат лития, Li3PO4, – бесцветное кристаллическое вещество ромбической сингонии, плотность – 2,41 г/см3 (20 ºC); термически устойчив, не плавится и не разлагается до температуры красного каления, Тпл 1220 ºC. Ортофосфат лития – наименее растворимая соль лития. В 100 г воды растворяется 0,022 г при 0 ºC и 0,034 г при 18 ºC. В присутствии аммиака растворимость Li3PO4 уменьшается, а в присутствии аммонийных солей (NH4Cl) – увеличивается. Из водных растворов при обычной температуре осаждается Li3PO4∙2H2O, который после сушки при 60ºC переходит в полугидрат (Li3PO4∙0,5H2O), а выше 120ºC полностью обезвоживается. Li3PO4 легко разлагается сильными кислотами, труднее – уксусной.
Li3PO4 образует двойные соли с фосфатами других щелочных металлов и аммония, обычно лучше растворимые в воде, чем Li3PO4. Для получения ортофосфата лития используют нейтрализацию H3PO4 избытком LiOH, однако при этом, помимо Li3PO4, образуется основной фосфат лития 2Li3PO4∙LiOH, поэтому применяют осаждение Li3PO4 из раствора соли лития Na2HPO4 в слабощелочном растворе:
3LiX + Na2HPO4 + NaOH = Li3PO4 + 3NaX + H2O (8)
Добавление NaOH обязательно, иначе образуется растворимый Li2HPO4, что ведет к потерям лития.
Незначительная растворимость Li3PO4 в воде используется в аналитической химии для отделения лития от других щелочных металлов и его количественного определения. В технологических схемах применяется осаждение Li3PO4 для доизвлечения лития из различных маточных растворов (содержащих натрий и калий), после первичного извлечения лития в виде Li2CO3. Для перевода Li3PO4 в растворимые соединения используют взаимодействие Li3PO4 с CaCl2 в расплаве при 850 ºC:
2Li3PO4 + 3CaCl2 = 6LiCl + Ca3(PO4)2 (9)
Карбонат лития, Li2CO3, – бесцветное мелкокристаллическое вещество, кристаллизуется в моноклинной сингонии (a = 8,39; b = 5,00; c = 6,21 Ǻ, β = 114,5º), плотность 2,11 г/см3(0 ºC); энтальпия образования ΔH = – 1078,70 кДж/моль; Т пл. 732 ºC. Карбонат лития – термически неустойчивое соединение, уже при температуре плавления заметно диссоциирует:
Li2CO3→Li2O + CO2. (10)
Давление CO2 становится равным атмосферному при 1270 ºC; карбонат лития менее стоек, чем карбонаты натрия и калия, термическая диссоциация ускоряется в вакууме и в присутствии углерода вследствие восстановления CO2 до CO и смещения равновесия реакции влево. Оксид лития в расплаве Li2CO3 очень агрессивен – разрушает корунд, алунд, диоксид циркония и платину. По ряду свойств карбонат лития сходен с карбонатом кальция.
 |
Растворимость Li2CO3 мала, она значительно ниже
растворимости
|
При 20 ºC она составляет 1,33 г /100 г H2O. С повышением температуры, как видно из рис. 5, растворимость понижается, т.е. карбонат лития имеет отрицательный температурный коэффициент растворимости. Кристаллогидратов карбонат лития не образует, в водных растворах заметен гидролиз, который усиливается при кипячении. Карбонаты щелочных металлов не образуют с Li2CO3 соединений, они понижают растворимость Li2CO3, что объясняется действием одноименного иона. При пропускании CO2 через водную суспензию Li2CO3 карбонат лития растворяется вследствие образования более растворимого гидрокарбоната:
Li2CO3 + CO2 + H2O→2LiHCO3 (11)
Гидрокарбонат лития разлагается при нагревании, выделяя Li2CO3.
Чистый карбонат лития можно получить, пропуская CO2 в раствор LiOH. В промышленности его получают при действии поташом (K2CO3) или содой (Na2CO3) на растворы солей лития вблизи температуры кипения (90ºC).
Карбонат лития – важнейшее промышленное соединение лития, т.к. многие технологические схемы переработки литийсодержащего сырья заканчиваются осаждением Li2CO3. Кроме того, карбонат лития – источник получения другого технически важного соединения лития – LiOH и многочисленных солей лития.
Дата публикования: 2015-10-09; Прочитано: 2901 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
