 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Цикл Карно Тs– діаграмі
|
|
План
1 Другий закон термодинаміки, сутність та основні формулювання.
2 Ентропія як параметр стану робочого тіла.
3 Тs – діаграма.
4 Аналітичне дослідження і графічне зображення термодинамічних процесів в
Тs – діаграмі.
5 Цикл Карно в Тs – діаграмі.
1 З позицій І закону ТД припустимі будь-які процеси взаємоперетворення теплоти і ро-боти, якщо вони відбуваються в еквівалентних кількостях. Частина таких процесів мо-же протікати довільно, тобто без усякого зовнішнього впливу: наприклад, перетворен-ня механічної роботи в теплоту тертя, перехід теплоти від гарячих тіл до холодних. Одначе здійснення деяких процесів можливо тільки при виконанні додаткових умов, тобто такі процеси не можуть протікати довільно: наприклад, перехід теплоти від хо-лодних тіл до гарячих повинен супроводжуватися обов’язковою витратою додаткової зовнішньої роботи.
Якщо І закон ТД встановлює еквівалентність теплоти і роботи, то ІІ закон вста-новлює напрямок, в якому відбуваються реальні процеси, і необхідні для їх здійснення умови. Обидва закони відкриті дослідним шляхом.
Перш ніж сформулювати ІІ закон ТД, згадаємо особливості здійснення колових процесів (циклів). В прямих циклах (циклах теплових двигунів) підведена від тепло-віддатчика до робочого тіла теплота  не може бути повністю перетворена в корисну роботу, бо частина теплоти в кількості
не може бути повністю перетворена в корисну роботу, бо частина теплоти в кількості 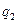 обов’язково повинна бути передана від робочого тіла до теплоприймача з більш низькою температурою. В зворотних циклах (циклах холодильних машин) відведення теплоти від менш нагрітих тіл (тепловід-датчиків) до більш нагрітих (теплоприймачів) відбувається тільки за умов обов’язкової витрати зовнішньої роботи, яка потім у формі теплоти також передається теплоприймачам.
обов’язково повинна бути передана від робочого тіла до теплоприймача з більш низькою температурою. В зворотних циклах (циклах холодильних машин) відведення теплоти від менш нагрітих тіл (тепловід-датчиків) до більш нагрітих (теплоприймачів) відбувається тільки за умов обов’язкової витрати зовнішньої роботи, яка потім у формі теплоти також передається теплоприймачам.
Таким чином, не можна здійснити такий періодично діючий тепловий двигун, за допомогою котрого можна було б повністю перетворити в роботу всю теплоту, яка надана робочому тілу тепловіддатчиком. Це і є одне з формулювань ІІ закону ТД.
Якщо б вдалося побудувати тепловий двигун, що працює при наявності тільки одного джерела теплоти, тобто врахувати колосальні запаси енергії в навколишніх ті-лах (земна поверхня, вода в морях, океанах і ріках), такий двигун практично міг би працювати безмежно довго. Тому одне з формулювань ІІ закону ТД стверджує, що не-можливо здійснити вічний двигун другого роду, тобто двигун, який перетворює пов-ністю в роботу теплоту, яка отримана від єдиного джерела теплоти.
В зворотних циклах, тобто в циклах холодильних машин, згідно ІІ закону ТД відведення теплоти від менш нагрітих тіл (тепловіддатчиків) до більш нагрітих (тепло-приймачів) можна здійснити тільки за умови обов’язкової витрати зовнішньої роботи, яка потім у вигляді теплоти передається теплоприймачам.
Існують також інші формулювання ІІ закону ТД:
· в коловому процесі теплота, яка підводиться, не може бути повністю перетво-рена в роботу;
· для перетворення теплоти в роботу потрібно мати не тільки нагрівач, але й охо-лоджувач (холодильник) з більш низькою температурою, тобто температурний перепад;
· теплота не може сама по собі переходити від тіл з більш низькою температу-рою до тіл з більш високою температурою.
2 Ентропія є шостим параметром стану робочого тіла. Вона характеризує напрямок
процесу теплообміну між системою і зовнішнім середовищем.
Для довільної маси газу  (кг) ентропія позначається
(кг) ентропія позначається  і вимірюється
і вимірюється  , для 1 кг газу -
, для 1 кг газу - 
 , тобто в тих же самих одиницях, що й масова теплоємність.
, тобто в тих же самих одиницях, що й масова теплоємність.
В ТТД визначають лише зміну ентропії  . Тому умовно вважають, що при 0
. Тому умовно вважають, що при 0  і при будь – якому тиску
і при будь – якому тиску  , як і внутрішня енергія
, як і внутрішня енергія  .
.
Ентропія визначається по формулі
 , (1.65)
, (1.65)
де  - кількість теплоти, яка бере участь в довільному термодинамічному процесі,
- кількість теплоти, яка бере участь в довільному термодинамічному процесі,
 ; Т – абсолютна температура, К.
; Т – абсолютна температура, К.
Відношення  називається приведеною теплотою та уявляє собою якісну характеристику процесу перетворення теплоти.
називається приведеною теплотою та уявляє собою якісну характеристику процесу перетворення теплоти.
3 Введення поняття ентропії дозволяє застосувати для дослідження термодинамічних процесів нову (замість введеної раніше 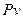 - діаграмі) прямокутну систему координат
- діаграмі) прямокутну систему координат
Тs - Тs– діаграму. По вертикальній осі відкладається абсолютна температура Т, по осі абсцис (горизонтальній) – ентропія s. Цю діаграму ще називають тепловою або ентропійною. В нійплоща, обмежена зверху кривою, по боках – перпендикулярами, які опущені з точок початкового і кінцевого стану на ось абсцис та віссю абсцис виражають кількість теплоти, яка підводиться або відводиться (рисунок 1.9).
 За допомогою Т s – діаграми можна визначати теплоємність робочого тіла в
За допомогою Т s – діаграми можна визначати теплоємність робочого тіла в
будь – якому процесі в заданому стані і встановити її
знак. Через те, що в рівнянні (1.65) Т завжди позитивна
величина, то  і
і  мають однакові знаки. Тобто якщо
мають однакові знаки. Тобто якщо
теплота підводиться до газу (величина позитивна), то і
 збільшується, і навпаки.
збільшується, і навпаки.
Рисунок 1.9 - Тs– діаграма
Зміна ентропії може бути розрахована по одній з трьох формул при відомих параметрах 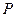 ,
, 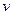 і
і 
 , (1.66)
, (1.66)
 , (1.67)
, (1.67)
 . (1.68)
. (1.68)
4 Термодинамічні процеси газів в Тs– діаграмі.
Ізохорний процес. При 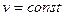 з рівняння (1.66) отримують
з рівняння (1.66) отримують
 |
 . (1.69)
. (1.69)
Отже, ізохора зображується логарифмічною кривою,
поверненою випуклістю в бік осі абсцис. Площа під
кривою процесу зображує підведену теплоту, яка в
цьому випадку дорівнює зміні внутрішньої енергії
(рисунок 1.10).
Рисунок 1.10 - Ізохорний процес в Тs– діаграмі
Ізобарний процес. При  рівняння (1.67) і (1.68) приводять до вигляду
рівняння (1.67) і (1.68) приводять до вигляду
 . (1.70)
. (1.70)
Ізобарний процес в Тs– діаграмі зображується також логарифмічною кривою Але при одних і тих же значеннях температур 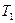 і
і  зміна ентропії в ізобарному процесі буде більше, ніж в ізохорному, бо
зміна ентропії в ізобарному процесі буде більше, ніж в ізохорному, бо  . Тому ізобара буде більш пологою лінією, ніж ізохора (рисунок 1.11).
. Тому ізобара буде більш пологою лінією, ніж ізохора (рисунок 1.11).
 Ізотермічний процес. Через те що процес протікає при
Ізотермічний процес. Через те що процес протікає при  , ізотерма – го-ризонтальна лінія, причому при розширенні – це лінія 1–2, через те що процес протікає з підведенням теплоти, і зі збільшенням ентропії; при стисненні - лінія
, ізотерма – го-ризонтальна лінія, причому при розширенні – це лінія 1–2, через те що процес протікає з підведенням теплоти, і зі збільшенням ентропії; при стисненні - лінія 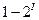 , тобто ентропія зменшується, бо в цьому випадку теплота відводиться (рисунок 1.12).
, тобто ентропія зменшується, бо в цьому випадку теплота відводиться (рисунок 1.12).
 |
Рисунок 1.11 – Ізобарний процес в Рисунок 1.12 – Ізотермічний процес в
Тs– діаграмі Тs– діаграмі
Зміна ентропії в ізотермічному процесі визначається з рівняння
 . (1.71)
. (1.71)
Адіабатний процес. В адіабатному процесі 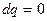 , тому
, тому

 і
і  . (1.72)
. (1.72)
Отже, оборотний адіабатний процес зображу-
ється вертикальною лінією (рисунок 1.13). Про-
цес стиснення направлений в бік підвищення
температури – вгору, а процес стиснення – вниз,
в бік зниження температури.
Рисунок 1.13 – Адіабатний процес в Тs– діаграмі
5 Оборотний прямий цикл Карно, який складається з двох ізотерм і двох адіабат, в
Тs– діаграмі зображується прямокутником АВСD (рисунок 1.14) і протікає в інтервалі температур 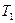 гарячого джерела теплоти і
гарячого джерела теплоти і  - холодного. Термічний ККД циклу за буде визначено за допомогою Тs– діаграми.
- холодного. Термічний ККД циклу за буде визначено за допомогою Тs– діаграми.
На рисунку 1.14 АВ – ізотермічний процес розширення, в якому до газу підво-диться теплота
 ,
,
CD – ізотермічний процес стиснення, в якому газ віддає теплоту
 .
.
Вертикальні лінії ВС і DA зображують відповідно адіабатні процеси розширення і стиснення.
Термічний ККД циклу
 . (1.73)
. (1.73)
 Таким чином, вираз термічного ККД циклу
Таким чином, вираз термічного ККД циклу
Карно отримано значно простіше, ніж раніше при
використанні 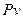 - діаграми.
- діаграми.
Рисунок 1.14 – Оборотний цикл Карно в Тs– діаграмі
Дата публикования: 2015-09-17; Прочитано: 806 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
