 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Термодинамічні процеси, види. Алгоритм дослідження
|
|
План
1 Перший закон термодинаміки, формулювання та аналітичний вираз.
2 Основні термодинамічні процеси та алгоритм їх дослідження.
3 Ізохорний процес.
4 Ізобарний процес.
5 Ізотермічний процес.
6 Адіабатний процес.
1 Нехай 1 кг газу здійснює довільний процес за рахунок підведеної зовні теплоти  , при цьому температура та об’єм газу збільшуються. В результаті підвищення темпера-тури й збільшення об’єму газу його внутрішня енергія підвищується. Якщо на початку процесу внутрішня енергія газу дорівнює
, при цьому температура та об’єм газу збільшуються. В результаті підвищення темпера-тури й збільшення об’єму газу його внутрішня енергія підвищується. Якщо на початку процесу внутрішня енергія газу дорівнює 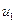 , а в кінці
, а в кінці 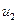 , тоді повна зміна внутрішньої енергії дорівнює
, тоді повна зміна внутрішньої енергії дорівнює
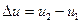 . (1.34)
. (1.34)
Крім цього, збільшення об’єму газу означає, що він здійснює роботу проти зовнішніх сил, оскільки газ оточений середовищем, тобто роботу розширення  .
.
Якщо в процесі не змінюється зовнішня кінетична енергія газу і в ньому не від-буваються хімічні і будь – які інші зміни, то згідно закону збереження і перетворення енергії для розгляданого процесу баланс енергії виражається рівнянням
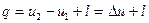 . (1.35)
. (1.35)
Рівняння (1.35) є математичним виразом першого закону термодинаміки для кін-цевого процесу. З нього витікає, що теплота, яка підводиться, витрачається на зміну внутрішньої енергії і на здійснення зовнішньої роботи (проти зовнішніх сил).
Отриманий вираз першого закону термодинаміки можна надати в наступному вигляді
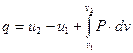 . (1.36)
. (1.36)
Кожна з величин, котрі входять в рівняння (1.35) - (1.36), може бути позитивною, негативною і рівною нулю. Підведена теплота до тіла є позитивною (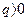 ), а відведена - негативною (
), а відведена - негативною (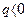 ). Зміна внутрішньої енергії вважається позитивною (
). Зміна внутрішньої енергії вважається позитивною (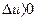 ) при під-вищенні температури газу і негативною (
) при під-вищенні температури газу і негативною (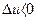 ) при її зменшенні.
) при її зменшенні.
2 Зміна стану газу характеризується зміною всіх його основних параметрів 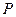 , v і Т, при цьому теплота або підводиться, або відводиться від газу. Такі процеси назива-ються політропними. Найбільш практичний і теоретичний інтерес мають процеси, в яких будь–який з основних параметрів не змінюється або процес здійснюється без теплообміну з зовнішнім середовищем. Таких процесів 4:
, v і Т, при цьому теплота або підводиться, або відводиться від газу. Такі процеси назива-ються політропними. Найбільш практичний і теоретичний інтерес мають процеси, в яких будь–який з основних параметрів не змінюється або процес здійснюється без теплообміну з зовнішнім середовищем. Таких процесів 4:
1) ізохорний (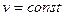 ); 3) ізотермічний (
); 3) ізотермічний ( ;
;
2) ізобарний (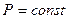 ); 4) адіабатний (
); 4) адіабатний (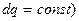 .
.
Ці процеси є основними. Алгоритм дослідження кожного процесу такий:
а) записують рівняння процесу, будують його графік в 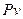 - координатах;
- координатах;
б) визначають залежності між параметрами стану газу, котрі змінюються;
в) визначають кількість теплоти, яка підводиться до газу  , зміну його внутрішньої
, зміну його внутрішньої
енергії 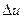 та ентальпії
та ентальпії 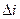 ;
;
г) визначають роботу 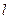 , яка здійснюється газом при розширенні;
, яка здійснюється газом при розширенні;
д) будують графік процесу в 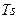 - координатах і визначають зміну ентропії процесу.
- координатах і визначають зміну ентропії процесу.
Усі процеси розглядаються як рівноважні та оборотні, при дослідженнях засто-совують рівняння стану ідеального газу і перший закон термодинаміки.
3 а) Ізохорним називають процес, який протікає при постійному об’ємі, його рівняння
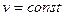 .
.
Графік процесу в 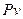 - координатах показаний на рисунку 1.5. В цих координа-тах ізохора зображується вертикальною лінією, при нагріванні направленою вгору, при охолодженні – вниз.
- координатах показаний на рисунку 1.5. В цих координа-тах ізохора зображується вертикальною лінією, при нагріванні направленою вгору, при охолодженні – вниз.
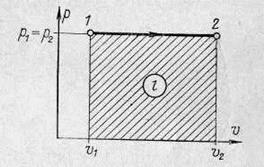
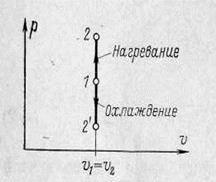
Рисунок 1.5 – Ізохорний процес Рисунок 1.6 – Ізобарний процес
б) Залежність між параметрами стану, котрі змінюються в даному процесі, знаходять з рівняння стану
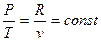 або
або 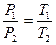 (1.37,1.38)
(1.37,1.38)
тобто абсолютний тиск змінюється прямо пропорційно абсолютній температурі. Це означає, що при підведенні теплоти до газу (нагріванні) його абсолютний тиск і абсо-лютна температура підвищуються, при відведенні теплоти (охолодженні) – зменшу-ються.
в) Зміна внутрішньої енергії ідеального газу не залежить від властивостей або характе-ру процесу і може бути визначена по формулах
при постійній теплоємності 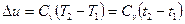 , (1.39)
, (1.39)
при змінній 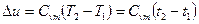 (1.40)
(1.40)
Отримані рівняння зміни внутрішньої енергії (1.39), (1.40) дійсні для будь – яких процесів.
Зміна ентальпії визначається по формулах
при постійній теплоємності 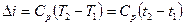 , (1.41)
, (1.41)
при змінній 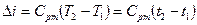 . (1.42)
. (1.42)
Рівняння (1.41) і (1.42) дійсні для будь – яких процесів в ідеальних газах.
г) При 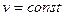
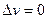 - зміна питомого об’єму не відбувається і робота
- зміна питомого об’єму не відбувається і робота
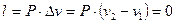 або
або 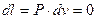 , (1.43)
, (1.43)
отже, в цьому процесі робота не здійснюється і тому теплота витрачається повністю на зміну внутрішньої енергії газу
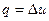 . (1.44)
. (1.44)
4 а) Процес, який протікає при постійному тиску, називають ізобарним. Рівняння про-
цесу 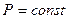 .
.
Графік процесу в 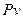 - координатах показаний на рисунку 1.6. В цих координа-тах ізохора зображується горизонтальною лінією, паралельною осі
- координатах показаний на рисунку 1.6. В цих координа-тах ізохора зображується горизонтальною лінією, паралельною осі 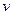 . б) Залежність між змінними значеннями питомих об’ємів та абсолютних температур відома з закону Гей – Люсака
. б) Залежність між змінними значеннями питомих об’ємів та абсолютних температур відома з закону Гей – Люсака
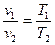 . (1.45)
. (1.45)
Таким чином, при збільшенні питомого об’єму газу абсолютна температура його підвищується, при зменшенні – знижується.
в) Зміна внутрішньої енергії визначається по формулах
при постійній теплоємності 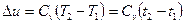 , (1.46)
, (1.46)
при змінній 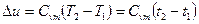 , (1.47)
, (1.47)
а зміна ентальпії –
при постійній теплоємності 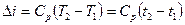 , (1.48)
, (1.48)
при змінній 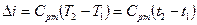 . (1.49)
. (1.49)
Робота розширення на рисунку 1.7 зображується заштрихованою площею під лінією 1-2 і визначається по рівнянню
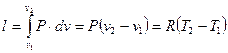 . (1.50)
. (1.50)
г) Кількість теплоти, підведеної до газу в ізобарному процесі, можна знайти з першого закону термодинаміки
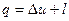 , (1.51)
, (1.51)
звідки мають:
при постійній теплоємності
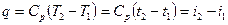 , (1.52)
, (1.52)
при змінній теплоємності
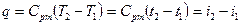 . (1.53)
. (1.53)
5 а) Процес, який протікає при постійній температурі (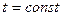 або
або 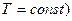 , назива-
, назива-
ється ізотермічним.
 У відповідності з рівнянням стану для ідеально-
У відповідності з рівнянням стану для ідеально-
го газу отримують
 ,
,
тому друге рівняння процесу, яке виражає
закон Бойля – Маріота, має вигляд
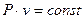 . (1.54)
. (1.54)
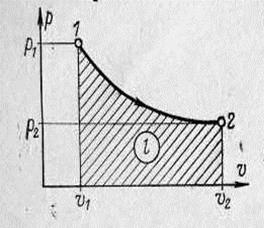
В координатах 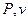 ізотермічний процес зобра-
ізотермічний процес зобра-
жується гіперболічною кривою (рисунок 1.7).
Рисунок 1.7 – Ізотермічний процес
б) З рівняння (1.54) витікає
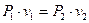 (1.55)
(1.55)
або  , (1.56)
, (1.56)
тобто при постійній температурі абсолютний тиск газу змінюється зворотно пропор-ційно питомому об’єму (закон Бойля – Маріота).
в) Зміни внутрішньої енергії та ентальпії ідеального газу залежать тільки від темпера-ратури, тому в ізотермічному процесі
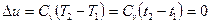 і
і 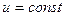 ;
;
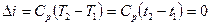 і
і 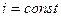 .
.
Тоді у відповідності до першого закону термодинаміки по рівнянню (1.51) отри-мують
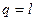 ,
,
тобто в ізотермічному процесі вся теплота, яка надається газу, витрачається повністю на роботу розширення.
г) Знаходять роботу процесу, користуючись рівнянням
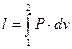 . (1.57)
. (1.57)
Через те що 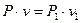 і
і 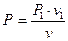 ,
,
то 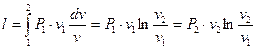 . (1.58)
. (1.58)
6 а) Адіабатним називається процес, який здійснюється без теплообміну між газом і зовнішнім середовищем. В такому процесі теплота не підводиться і не відводиться,
тому одним із рівнянь процесу є 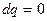 або
або 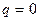 .
.
Друге рівняння процесу має вигляд
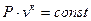 , (1.59)
, (1.59)
де 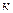 - коефіцієнтом адіабати. Рівняння (1.59) дає аналітичну залежність між змінними параметрами
- коефіцієнтом адіабати. Рівняння (1.59) дає аналітичну залежність між змінними параметрами 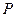 і
і 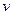 .
.
В 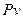 - діаграмі адіабата зображується кривою лінією, яка близька до гіперболи,
- діаграмі адіабата зображується кривою лінією, яка близька до гіперболи,
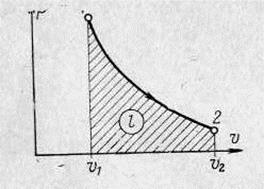 що зміщена відносно координатних осей (ри-
що зміщена відносно координатних осей (ри-
сунок 1.8). осей (рисунок 10). б) Записують рівняння між параметрами стану,
які змінюються в даному процесі:
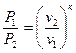 або
або 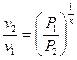 ; (1.60)
; (1.60)
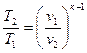 і
і 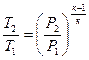 . (1.61)
. (1.61)
Рисунок 1.8 – Адіабатний процес
в) В адіабатному процесі теплота не підводиться і не відводиться (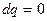 ). Тому робота в цьому процесі здійснюється за рахунок внутрішньої енергії газу, тоді
). Тому робота в цьому процесі здійснюється за рахунок внутрішньої енергії газу, тоді
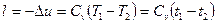 . (1.62)
. (1.62)
Але 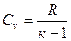 , тому можна записати
, тому можна записати
 . (1.63)
. (1.63)
Через те що
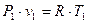 і
і 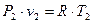 ,
,
то 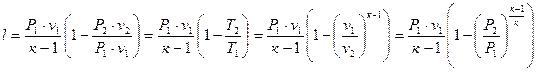 . (1.64)
. (1.64)
Теплоємність процесу
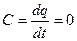 .
.
Дата публикования: 2015-09-17; Прочитано: 2750 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
