 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Поняття про термодинамічну систему, термодинамічний процес. Ідеальний та реальні гази. Закони ідеального газу. Рівняння стану ідеального газу
|
|
План
1 Поняття про термодинамічну систему, термодинамічний процес.
2 Ідеальний та реальні гази. Закони ідеального газу.
3 Рівняння стану ідеального газу. Газова постійна та універсальна газова постійна.
1 Термодинамічна система – сукупність матеріальних тіл і полів, які взаємодіють між собою і зовнішнім середовищем, тобто обмінюються енергією і речовиною.
Термодинамічна система, яка не обмінюється з зовнішнім середовищем ні енер-гією, ні речовиною, називається ізольованою або замкненою.
Якщо з плином часу параметри стану термодинамічної системи при постійних зовнішніх умовах не змінюються, то вона знаходиться в рівноважному стані.
Всяка зміна параметрів стану робочого тіла називається термодинамічним про-цесом, або скорочено процесом. Кожен процес здійснюється при тепловій і механіч-ній взаємодії робочого тіла з зовнішнім навколишнім середовищем, при цьому стан останнього також змінюється.
Термодинамічний процес, який складається з безперервного ряду рівноважних станів, називається рівноважним.
При вивченні термодинамічних процесів використовується їх графічне зобра-ження в різних координатних системах, зокрема, в системі координат 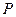 і
і  , яка нази-вається
, яка нази-вається  діаграмою. По осі ординат відкладаються абсолютні тиски, по осі абсцис – питомі об’єми газу. При заданих
діаграмою. По осі ординат відкладаються абсолютні тиски, по осі абсцис – питомі об’єми газу. При заданих 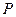 і
і  рівноважний стан зображується точкою, а рівноважний процес – в загальному випадку кривою лінією.
рівноважний стан зображується точкою, а рівноважний процес – в загальному випадку кривою лінією.
Зобразимо в  діаграмі довільний рівноважний процес лінією 1–2 (рису-
діаграмі довільний рівноважний процес лінією 1–2 (рису-
нок 1.3). З графіку видно, що при переході газу з початкового стану 1 в кінцевий 2 відбувається зниження тиску і збільшення питомого об’єму. Це є процесом розши-рення газу, який вважається прямим процесом. Зворотний процес -це процес стиснення газу, коли він із стану 2 переходить в початковий 1; при цьому відбувається зменшення питомого об’єму і збільшення тиску.
 Характерною властивістю рівноважних про-
Характерною властивістю рівноважних про-
цесів є їхня оборотність. Це означає, що якщо
при розширенні зі стану 1 газ проходить через
проміжні рівноважні стани а, в, с, f, m (рису-
нок 1.3), то при зворотному процесі стиснення зі
стану 2 газ пройде через ті ж стани, але в зворот-
ній послідовності m, f, c, в, а і повернеться в
початковий стан 1.
У зв’язку з цим рівноважні процеси назива-
ються оборотними процесами.
Рисунок 1.3 – Зображення оборотного процесу
В результаті протікання спочатку прямого, а потім зворотного рівноважних процесів в термодинамічній системі „робоче тіло – довкілля” ніяких змін не відбудеть-
ся.
Рівноважні оборотні процеси є ідеальними, які в першу чергу розглядаються ТД. Всі реальні процеси протікають з великою швидкістю і при наявності кінцевої різниці температур і тисків між газом та зовнішнім середовищем. Тому ці процеси будуть нерівноважними і, отже, необоротними. Вивчати реальні необоротні процеси важко, і тому ТД вивчає тільки теоретичні оборотні процеси. Це виправдовується також і тим, що на практиці відхилення реальних процесів від ідеальних незначне і не приймається до уваги. При великих відхиленнях перехід від ідеальних процесів до реальних здійснюється шляхом введення поправочних коефіцієнтів, отриманих у дослідах.
2 Реальні гази складаються з атомів і молекул, які знаходяться в безперервному хаотичному русі. Між молекулами діють сили притягання і відштовхування, об’єм часток має кінцеву величину. Одначе часто гази знаходяться в такому стані, коли сили взаємодії незначні, як й об’єм молекул, тому і тим, і іншим можна знехтувати.
Газ, у котрого відсутні сили взаємодії між молекулами, а їхній об’єм у порівнянні з повним об’ємом, який займає газ, дорівнює нулю, називається ідеальним.
Введення поняття „ідеальний газ” має велике значення, бо дозволяє достатньо просто одержати аналітичні залежності, які описують його поведінку. Ці залежності в ряді випадків можуть бути застосовані до опису поведінки реальних газів. Такі гази, як кисень, водень, азот, повітря при відносно низьких тисках і високих температурах за своїми властивостями стають схожими до властивостей ідеального газу. Тому при термодинамічних дослідженнях процесів, які протікають в цих газах, використовують закони і рівняння стану ідеального газу. Введення поняття ідеального газу полегшило завдання термодинамічних досліджень, дозволило отримати прості математичні рівняння для підрахунку різних фізичних величин, які характеризують зміну стану робочого тіла.
Закон Бойля – Маріота. Якщо постійна кількість газу (наприклад, 1 кг) при постійній температурі ( ) буде переходити з одного стану з параметрами
) буде переходити з одного стану з параметрами  ,
,  в інший - з параметрами
в інший - з параметрами  ,
,  , то його абсолютний тиск буде змінюватися зворотно пропорційно питомому об’єму, тобто
, то його абсолютний тиск буде змінюватися зворотно пропорційно питомому об’єму, тобто
 або
або  (1.11,1.12)
(1.11,1.12)
При постійній температурі добуток абсолютного тиску на питомий об’єм даної маси газу є величина постійна.
Закон Гей – Люсака. Якщо нагрівати або охолоджувати постійну кількість газу (наприклад, 1 кг) при постійному тиску ( ), то питомий об’єм газу змі-нюється прямо пропорційно його абсолютній температурі, тобто
), то питомий об’єм газу змі-нюється прямо пропорційно його абсолютній температурі, тобто
 (1.13)
(1.13)
Закон Авогадро. В рівних об’ємах різних газів міститься однакова кількість молекул, якщо ці гази будуть мати однакові абсолютні тиски і температури.
З закону Авогадро витікає, що при однакових абсолютних температурах і тисках щільність газів пропорційна їх молекулярним масам 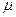 , тобто
, тобто
 (1.14)
(1.14)
Через те що,  ,
,  , звідки
, звідки 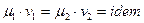 (1.15)
(1.15)
Кількість газів в грамах, яка дорівнює числу одиниць молекулярної маси, нази-вається молем. Моль визначається як кількість речовини, яка містить стільки ж моле-кул, скільки міститься атомів в вуглецю-12 масою 0,012 кг. Один кіломоль дорівнює 1000 молей і позначається 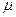 ,
,  . Добуток
. Добуток  є об’ємом кіломолю газу
є об’ємом кіломолю газу  ,
,  .
.
При нормальних фізичних умовах ( ,
,  ) об’єм одного кіломолю будь-якого газу дорівнює 22,4
) об’єм одного кіломолю будь-якого газу дорівнює 22,4  , тому
, тому
 . (1.16)
. (1.16)
Звідси щільність і питомий об’єм будь – якого газу при нормальних фізичних умовах визначаються з простих співвідношень:
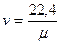 ,
, 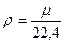 . (1.17,1.18)
. (1.17,1.18)
3 Для рівноважного стану газу існує однозначна залежність між його основними пара-метрами 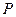 , v і Т, яка виражається аналітичним рівнянням, що називається рівнянням стану. Воно було отримано Клапейроном в 1834 р. шляхом використання дослідних законів Бойля – Маріота і Гей – Люсака і має вигляд:
, v і Т, яка виражається аналітичним рівнянням, що називається рівнянням стану. Воно було отримано Клапейроном в 1834 р. шляхом використання дослідних законів Бойля – Маріота і Гей – Люсака і має вигляд:
для 1 кг  , (1.19)
, (1.19)
для довільної маси газу 
 , (1.20)
, (1.20)
для 1 кмоля газу  , (1.21)
, (1.21)
Останнє рівняння називають рівнянням Менделєєва – Клапейрона, а величину
 - універсальною газовою постійною, бо для всіх газів і в певному стані вона має одне й те ж значення. Визначити це значення можна по рівнянню (1.21), якщо параметри стану
- універсальною газовою постійною, бо для всіх газів і в певному стані вона має одне й те ж значення. Визначити це значення можна по рівнянню (1.21), якщо параметри стану 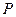 і Т взяти при нормальних умовах (
і Т взяти при нормальних умовах ( =101325 Па, Т= -273,15
=101325 Па, Т= -273,15  )
)

 (1.22)
(1.22)
Величина  (
( ) є індивідуальною характеристикою даної речовини і назива-ється газовою постійною. Визначається виразом
) є індивідуальною характеристикою даної речовини і назива-ється газовою постійною. Визначається виразом
 . (1.23)
. (1.23)
Дата публикования: 2015-09-17; Прочитано: 1428 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
