Из исходных n АО возникает n МО. Так, при образовании двухатомной молекулы H2 из атомов Н из s-орбиталей двух атомов Н возникают две двухцентровые МО — одна энергетически более выгодная (связывающая σsсв), другая менее выгодная (разрыхляющая σs*), чем исходные атомные орбитали. На связывающей МО электрон большую часть времени пребывает между ядрами (повышается электронная плотность), способствуя их химическому связыванию. Нa разрыхляющей же МО электрон большую часть времени находится за ядрами, вызывая отталкивание ядер друг от друга. Заселение электронами связывающей МО σсв стабилизирует систему, а заселение разрыхляющих – дестабилизирует ее (табл. 4.6.).
| Молекулярные параметры
| Молекулы и молекулярные ионы
| | МО
| 
| 
| 
| 
| | σ*
| 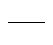
| 
| 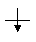
| 
| | σсв
| 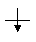
| 
| 
| 
| | E св, кДж∙моль–1
|
|
|
|
| | Длина связи, r 0, нм
| 0,1
| 0,075
| 0,108
| –
| | Порядок связи
| 0,5
|
| 0,5
|
| |
| Таблица 4.6. Энергия, длина и порядок связи в молекулах элементов 1 периода
|