 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Растворы сильных электролитов
|
|
Сильные электролиты – вещества, которые при растворении практически полностью диссоциируют на ионы.
Понятие «сильный электролит» относительно. Оно характеризует не только растворяемое вещество, но и растворитель. Хлороводород, растворённый в воде, — сильный электролит, а хлороводород, растворённый в безводной уксусной кислоте, — слабый. Причина электролитической диссоциации электролитов в водных растворах является гидратация.
Например: NaCl + (a +b)H2O = Na+ · aH2O + Cl- · bH2O. В результате гидратации образуются гидратированные ионы натрия и хлора.
Вследствие электростатического взаимодействия в растворах любых концентраций вблизи катиона находятся преимущественно анионы, а вблизи аниона – катионы. Взаимное расположение ионов различного знака таково, что каждый из них окружён ионной атмосферой из противоположно заряженных ионов. С изменением концентрации раствора меняется строение ионной атмосферы и химическая активность иона. С ростом концентрации проявляются электростатические силы, связывающие ионы, и химическая активность ионов становится меньше, чем их концентрация.
Закон действующих масс не учитывает взаимодействия ионов, и в растворах сильных электролитов наблюдается нарушение этого закона. Общая теория растворов, которая позволяла бы теоретически учесть все виды внутренних взаимодействий в растворах любых концентраций, пока ещё не создана. Поэтому по предложению американского физико-химика Г.Льюиса в выражении закона действующих масс концентрации заменены активностями. Активность молекул или ионов — это их эффективная концентрация, в соответствие с которой молекулы или ионы проявляют себя в химических и физических процессах. Значения активностей должны быть такими, чтобы при их подстановке сохранялась справедливость закона действующих масс.
Для равновесной реакции: aA + bB = cC + dD константа равновесия
после замены концентраций активностями выглядит так:
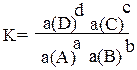
Активность иона или молекулы равна произведению его концентрации С на его коэффициент активности «f»: a = f ∙ C.
Коэффициенты активности ионов зависят от величины I, называемой ионной силой и вычисляемой по уравнению:
I = 0,5(C1z12 + C2z22 + C3z32 + …) =0,5∑ Cizi2,
где Ci - концентрация иона данного сорта, а zi – заряд этого иона.
Ионная сила учитывает электростатическое влияние всех ионов в растворе. Она имеет размерность концентрации и для растворов сильных однозарядных электролитов численно ей равна. В разбавленных растворах (I< 0,1M) коэффициенты активности ионов меньше единицы и уменьшаются с ростом ионной силы: при I→ 0 величина f→1. Растворы с очень низкой ионной силой(I<10-4М) можно считать идеальными.
С увеличением концентрации коэффициенты активности ионов начинают зависеть от природы ионов, а затем и от общего состава. В очень концентрированных растворах (I> 1M) коэффициенты активности ионов могут быть больше единицы. Одна из причин этого явления состоит в том, что в области очень высоких концентраций сказывается дегидратация, освобождение иона от гидратной оболочки и активность его снова растёт. Поэтому для нахождения коэффициентов активности следует пользоваться конкретными справочными данными (см. табл. 5 Приложения).
Пример 1. Рассчитайте рН раствора, содержащего в 1л 0,001 моль HCl и 0,06 моль CaCl2 с учетом и без учета коэффициентов активности.
Решение:
Уравнение протолиза: HCl + H2O = H3O+ + Cl–
а) без учета коэффициента активности:
[H3O+] = 0,001моль/л; рН = –lg[H3O+] = –lg10-3 = 3.
б) с учетом коэффициента активности:
Ионная сила раствора:
I = 0,5(0,001∙1 + 0,001∙1 + 0,06∙22 + 2∙0,06∙1)= 0,182.
Коэффициент активности иона H3O+ f= 0,824.
а(Н3O+) = 0,824∙0,001 =0,000824.
рН= –lgа(Н3O+) = – lg8,24 ∙10-4 = 3,08.
Пример 2. Рассчитайте рН 0,001М NaOH.
Решение:
pOH = –lg 10–3 = 3; pH = 14 – pOH = 14 – 3 = 11.
Пример 3. Рассчитайте рН раствора соляной кислоты с концентрацией 10–7моль/л.
Решение:
При концентрации сильного электролита < 10–6 моль/л пренебречь автопротолизом воды нельзя.
Уравнение электронейтральности: [H3O+] = [Cl–] + [OH–].
[Cl–] = [HCl]; [OH–] = Kw / [H3O+];
Тогда [H3O+] = [HCl} + Kw/[H3O+];
[H3O+]2 - [HCl] – Kw = 0;
______________
[H3O+] = 0,5([HCl] + √ [HCl]2 + 4Kw)
[Cl–] = 10–7 моль/л; [OH–] = K(H2O) / [H3O+] = 10–14/ [H3O+];
Тогда [H3O+] = 10–7 + 10–14/ [H3O+] или [H3O+]2 – 10–7 – 10 –14 = 0
_____________
Отсюда: [H3O+] = 0,5(10-7 + √ 10–14 + 4 ∙10–14 = 1,67 ∙ 10–7 моль/л.
pH = –lg1,67 ∙ 10–7 = 6,78.
Дата публикования: 2014-10-16; Прочитано: 2071 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
