 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Равновесия в растворах электролитов
|
|
Вещества, которые в растворе(или в расплаве) состоят полностью или частично из ионов называются электролитами. Различают сильные и слабые электролиты. Сильные электролиты – вещества, которые при растворении практически полностью диссоциируют на ионы. Слабые электролиты – это электролиты, которые в растворе неполностью диссоциируют на ионы. Свойства растворов слабых электролитов в значительной степени обусловлены существующими в них равновесиями между непродиссоциировавшими молекулами и ионами, которые образуются в результате частичной диссоциации молекул. Реакции диссоциации слабых электролитов описываются законом действующих масс и характеризуются константой и степенью диссоциации.
Равновесия в растворах кислот и оснований в химии выделяются в отдельный вид в связи с резким отличием катиона водорода от всех остальных ионов и важностью реакций с участием протона для большинства разделов химии, в том числе и биохимии. Существует несколько теорий кислотно-основных превращений. Первой теоретической концепцией была теория Аррениуса.
Согласно теории электролитической диссоциации Аррениуса, например, в водном растворе уксусная кислота распадается на ацетат ионы и ионы водорода:
CH3COOH(p) = CH3COO-(p) + H+(p)
Выражение закона действующих масс для реакции диссоциации уксусной кислоты:
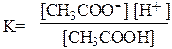
К – константа равновесия, которую для реакций диссоциаций называют константой диссоциации или константой ионизации; [CH3COO-],[H+] и [CH3COOH] – равновесные концентрации ацетат- ионов, ионов водорода и молекул уксусной кислоты.
Но теория Аррениуса не учитывает влияние растворителя и нельзя, в частности, представить существование катиона Н+ в растворе, так как протон лишён электронной оболочки, меньше других ионов и очень подвижен. Многие растворители обладают способностью переносить протоны к соответствующим акцепторам или присоединять протоны к молекуле растворителя. Это учитывает протолитическая теория Н.Бренстеда и Т. Лоури.
Одновременно с теорией Бренстеда и Лоури появилась теория Льюиса согласно которой кислоты—вещества, принимающие пару электронов, основания—вещества, отдающие её. Например, кислотами являются молекулы с незаполненной восьмиэлектронной оболочкой (BF3,SO3), катионы-комплеrсообразователи(Fe3+,Co2+), молекулы с поляризованными двойными связями (CO2,SO2), а основаниями— молекулы, содержащие свободные электронные пары(NH3,H2O), анионы, органические соединения с двойными и тройными связями.
Разновидностью теории Льюиса является концепция жёстких и мягких кислот Пирсона. Таким образом, в круг кислотно-основных реакций включается комплексообразование.
Наиболее общей теорией кислот и оснований является теория Усановича, в соответствии с которой кислоты — вещества, отдающие катионы или принимающие анионы или электроны; основания — вещества, отдающие анионы или электроны и принимающие катионы. Кислоты и основания Усановича включаюткислоты и основания Льюиса окислители и восстановители.
Согласно протолитической теории кислотами являются вещества― доноры протона, а основаниями ― акцепторы протона.
Кислотами и основаниями могут быть как нейтральные молекулы, так и ионы.
Пример кислот: HCl, H3PO4, HCOOH, H2O, PCl5, Cl2, H3O+, [Al(H2O)6]3+,HCO3-,NH4+.
Пример оснований: NH3, H2O, CH3NH2, C2H5OH, СаО, Cl–, CH3COO–, OH–, [Al(H2O)5OH]2+.
Некоторые вещества способны быть и донором и акцептором протонов. Такие вещества называются амфолитами. Например, H2О,HCO3–, [Al(H2O)5OH]2+.
Обратимые реакции с переносом протона от кислоты НА к основанию В называются кислотно-основными полуреакциями. Реакция между кислотой и основанием — «борьба» за протон между двумя основаниями:
НА + HL = LН2+ + А–
кислота 1 основание 2 кислота 2 основание 1
Кислота и получившееся при отдаче протона основание составляют сопряжённую пару. В этом уравнении это НА и А–, LН2+ и LH.
Примеры протолитических равновесий:
HCl + H2O = H3O+ + Cl– (1)
кислота-1 основание-2 кислота-2 основание-1
HCl + OH- = H2O + Cl– (2)
кислота-1 основание-2 кислота-2 основание- 1
H2O + NH3 = NH4+ + OH– (3)
кислота-1 основание-2 кислота-2 основание-1
NH4+ + H2O = H3O+ + NH3 (4)
кислота-1 основание-2 кислота- 2 основание-1
Растворитель является одним из участников протолитической реакции.
Вода как амфолит обладает как кислотными, так и основными свойствами. Такие растворители являются амфипротными. Важнейшая особенность амфипротных растворителей ― способность к передаче протона от одной молекулы растворителя к другой.
H2O + H2O = H3O+ + OH-
Такие процессы, в которых одна молекула растворителя проявляет свойства кислоты, а другая — основания, называется автопротолизом. Название иона Н3О+ — «гидроксоний». Константа автопротолиза воды Кw или Кн2о называется ионным произведением воды:
Кw = a(Н3О+) ∙a(ОН–) = 1,0 ∙ 10–14(25оС).
Ионное произведение воды независимо от изменения концентраций ионов при неизменной температуре остаётся постоянным.
В нейтральном растворе а(Н3О+)=а(ОН–) = 10–7 моль/л
В кислой среде а(Н3О+)>а(ОН–). В щелочной среде а(Н3О+)<а(ОН–).
Кислотность среды принято оценивать по водородному показателю рН, который равен отрицательному десятичному логарифму от активности иона Н3О+ (или Н+)
рН = – lg а(Н3О+) или рН = – lg а(Н+).
При малой ионной силе, когда активность иона практически равна его концентрации рН = – lg[H3O+].
Аналогично: гидроксильный показатель pOH = – lg a(OH–) или – lg[OH–].
Таким образом, в нейтральной среде рН = рОН = 7.
В кислой среде: рН < 7, рОН >7. В щелочной среде: рН > 7, рОН < 7.
рН + рОН = 14 (298К)
При взаимодействии с амфипротными растворителями (например, водой) растворённые вещества могут проявлять как кислотные свойства (ур-ие 4), так и основными свойствами (ур-ие 3).
Сила кислоты и основания характеризуется константами равновесий, которые называются соответственно константой кислотности Ка и константой основности Кb (см. табл. 4 Приложения).
НА + НL = LН2+ + А–
кислота-1 основание-2 кислота-2 основание-1
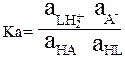
Эта константа показывает относительную кислотность кислоты НА по отношению основанию В, т.е. является константой кислотности Ка кислоты НА.
Например, протолитическое равновесие в водном растворе уксусной кислоты: СН3СООН + Н2О = СН3СОО– + Н3О+.
Константа кислотности уксусной кислоты Ка показывает, что уксусная кислота является более сильной кислотой, чем вода:

В уравнение не входит активность воды, которая принята равной единице.
Протолитическое равновесие в водном растворе соли уксусной кислоты:
СН3СОО– + Н2О = СН3СООН + ОН–
Константа этого протолитического равновесия является константой основности ацетат иона:

Константа основности ацетат иона Kb показывает, что ацетат ион является более сильным основанием, чем вода.
Константы кислотности и основности сопряжённой пары связаны между собой.
Перемножив Ка (СН3СООН) и Кb(СН3СОО-), получим:

Или в общем виде: HA + HL = LH2+ + A-
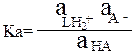
A- + HL = HA + L-
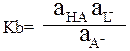
Произведение констант кислотности и основности Ka∙Kb сопряжённой пары НА и А– равно:
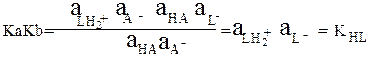
Активность растворителя HL принята равной единице.
При малой величине ионной силы константы кислотности и основности можно выразить через концентрации:

Константы химического равновесия, в том числе константы кислотности и основности, тоже принято выражать в логарифмической форме:
pKa = – lg Ka, а pKb = – lg Kb.
Для сопряжённых кислот и оснований pKa + pKb = 14 (298К)
Степень протолиза α слабого электролита представляет собой отношение концентрации одного из продуктов протолиза к равновесной концентрации протолита.
Например, степень протолиза уксусной кислоты:
α = [H3O+] / [CH3COOH]равн.
Математическая зависимость константы кислотности (или основности) и степень протолиза связаны законом разбавления Оствальда:
НА + Н2О = Н3О+ + А-
К = α2 ∙Сисх. / (1 – α).
Для малой величины степени протолиза α (1 – α) ≈ 1 и упрощённая формула имеет
вид: К = α2 ∙ Сисх.
где К – константа кислотности (Ka) или основности (Kb), в зависимости от
вида протолиза.
Если α <<5% то можно считать, что Сисх = [НА]равн. и, если пренебречь автопротолизом
воды: Ка = [H3O+] ∙ [A-] / [HA] = [H3O+]2 / Cисх.
______
[H3O+] = √Ka Cисх.
Если α > 5%, то [HA]равн ≠ Сисх. и тогда [НА]равн. = Сисх – [Н3О+].
Ка = [Н3О+] [А-] / [НА] = [H3O+]2 / (Сисх – [Н3О+])
[H3O+]2 + Ka [H3O+] – Ka Cисх. = 0
Решая квадратное уравнение, получим:
_____________
[H3O+] = 0,5 (–Ka + √Ka2 + 4Ka Cисх.)
Например, для 0,01M молочной кислоты:
_____________________
[H3O+] = 0,5 (–1,4∙10-4 + √ 1,96∙10-8 + 4∙1,4∙0-4∙10-2 = 1,12∙10-4моль/л;
pH = 2,95
Протолитические равновесия в растворах амфолитов:
Это― растворы кислых солей(NaHCO3,NaH2PO4 и т.п.), аминокислот и т.п. В таких растворах сосуществуют частицы и принимающие, и отдающие протоны.
Так, в растворе дигидрофосфата натрия существуют следующие протолитические равновесия:
H2PO4– + H2O = H3O+ HPO42– Ka(H2PO4–) = 6,2 ∙10–8
H2PO4– + H2O = H3PO4 + OH– Kb(H2PO4–) = 1,4 ∙10–12
В растворе гидрофосфата натрия — следующие:
HPO42– + H2O = H3O+ + PO43– Ka(HPO42–) = 4,6 ∙10–13
HPO42– + H2O = H2PO4– + OH– Kb(HPO42–) = 1,6 ∙ 10–7
В растворе дигидрофосфата натрия Ka>Kb. В растворе рН <7.
В растворе гидрофосфата натрия Kb>Ka. В растворе pH>7.
Приведённые примеры показывают, что протолитические равновесия смещены в сторону образования более слабых кислот и оснований. Таким образом, протолитическое равновесие можно рассматривать как конкуренцию различных по силе оснований за протон.
Пример 1 Рассчитайте степень диссоциации (протолиза), рН, с(Н3О +) и с(ОН-) в водном растворе уксусной кислоты с концентрацией 0,1моль/л. рКа(СН3СООН) = 4,76.
Решение:
Протолитическое равновесие: CH3COOH +H2O = CH3COO– + H3O+
Сопряжённые пары: кислота СН3СООН и сопряжённое с ней основание СН3СОО–; основание Н2О и сопряжённая с ним кислота Н3О+.
Константа протолитического равновесия — константа кислотности уксусной кислоты
Ка = 
Для слабых электролитов ионная сила мала и коэффициент активности можно принят равным 1.
Тогда: Ка = 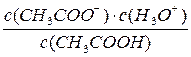
Поскольку с(СН3СОО–) =с(Н3О+), предыдущее выражение можно представить в виде:
Ка =  ; Тогда: Ка·с(CH3COOH) = c(H3O+)2.Прологарифмировав левую и правую часть, получим: рКа – lgc(CH3COOH) = 2pH
; Тогда: Ка·с(CH3COOH) = c(H3O+)2.Прологарифмировав левую и правую часть, получим: рКа – lgc(CH3COOH) = 2pH
Равновесная концентрация уксусной кислоты равна исходной за вычетом концентрации, подвергнутой протолизу:
сравн= сисх― с(Н3О+) [или с(СН3СОО-)]
Для слабых электролитов, в растворах которых концентрация ионов очень мала можно принять сисх – с(Н3О+)  сисх
сисх
Тогда: 4,76 – lg0,1 = 2pH. pH = 2,88. pOH = 14 – 2,88 = 11,12.
c(H3O+) =1,32·10-3; c(OH-) = 7,59·10-12. Степень протолиза:
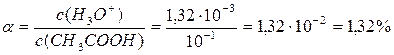
Пример 2. Рассчитайте [HCO3–] и [CO32–] в 0,01М растворе угольной кислоты, если рН этого раствора равен 4,5.
Ка1 = 4,45∙10–7 ; Ка2 =4,69∙10–11 .
Решение:
Протолитические равновесия:
1 ступень: H2CO3 + H2O = HCO3– + H3O+
2 ступень: HCO3– + H2O = CO32– + H3O+
pH = 4,5. Отсюда [H3O+] = 3,16∙10-5 моль/л
Константа протолиза (константа кислотности) по первой ступени:

Отсюда [HCO3–] = 4,45∙ 10-7 ∙ 10-2 / 3,16∙10-5 = 1,41∙10-4 моль/л.
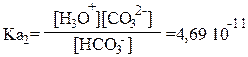
Отсюда [CO32–]=4,69∙10–11∙1,41∙10–4 / 3,16∙10–5 = 2,09∙10–10 моль/л.
Пример 3. Вычислите концентрационную константу кислотности уксусной кислоты в водном растворе при наличии в растворе соли Mg(NO3)2 с концентрацией 0,05 моль/л,
если рКо = 4,75.
Решение:
Термодинамическая константа кислотности уксусной кислоты:

Концентрационная константа кислотности уксусной кислоты:

a(CH3COO-) = f(CH3COO-) ∙ [CH3COO-]; a(H3O+) = f(H3O+) ∙ [H3O+]; a(СH3COOH) = f(CH3COOH) ∙ [CH3COOH].
Отсюда: Kо = Kc f(CH3COO-)∙f(H3O+) / f(CH3COOH∙), но поскольку для уксусной кислоты коэффициент активности практически равен 1,
то Kc = Kо / f(CH3COO- )∙f(H3O+).
Ионная сила раствора в основном определяется сильным электролитом ―солью: I = 0,5(0,05∙ 22 + 0,1∙1) = 0,15.
В соответствии с табл. 5 Приложения: f(CH3COO-) = 0,79, а f(H3O+) = 0,85.
Если рКо = 4,75, то Ко = 1,78∙10-5.
Тогда Кс = 1,78∙10-5 / 0,79∙0,85 = 2,65∙10-5
Пример 4. Рассчитайте рН 0,01М раствора молочной кислоты. Ка = 1,4 ∙ 10-4
Решение:
Протолитическое равновесие:
CH3CH(OH)COOH + H2O = CH3CH(OH)COO- + H3O+
Для слабых электролитов, у которых степень протолиза > 5%, уже нельзя считать концентрацию молекул, не подвергнутых протолизу, равной исходной концентрации электролита. Поэтому для молочной кислоты:
[CH3CH(OH)COOH]равн = [CH3CH(OH)COOH] исх. – [H3O+].
Тогда: Ka = [H3O+] ∙ [CH3CH(OH)COO–] / [CH3CH(OH)COOH]равн = [H3O+]2 / [CH3CH(OH)COOH] исх. – [H3O+]
[H3O+]2 + Ka[H3O+] – Ka[CH3CH(OH)COOH] исх. = 0
_______________________________
[H3O+] = 0,5(–Ka + √ Ka2 + 4Ka[CH3CH(OH)COOH]исх.
_________________________
[H3O+] = 0,5(–1,4 ∙ 10–4 + √ (1,4 ∙10–4)2 + 4∙ 1,4 ∙10–4 ∙10–2 =
= 1,12 ∙10–3 моль/л; pH = 2,9
Пример 5. Рассчитайте рН раствора HCN с концентрацией
10-6 моль/л. Ка = 6,2 ∙10–10
Решение:
Для слабых электролитов с концентрацией < 10–4 моль/л, у которых константа протолиза < 10–8 , необходимо учитывать автопротолиз воды.
Протолитическое равновесие: HCN + H2O = CN– + H3O+
Уравнение электронейтральности: [H3O+] = [CN–] + [OH–]
[OH–] = Kw/ [H3O+];
Ka = [H3O+] ∙ [CN–] / [HCN]; [CN-] = Ka [HCN] / [H3O+];
Поскольку кислота очень слабая, можно считать: [HCN]равн= [HCN] исх.
Тогда: [H3O+] = Ka ∙ [HCN]исх. / [H3O+] + Kw / [H3O+];
[H3O+]2 = Ka [HCN]исх. + Kw;
____________________ ____________________
[H3O+] = √ Ka [HCN]исх. + Kw = √ 6,2 ∙ 10–10 ∙ 10–6 + 10–14 =
=1,03 ∙ 10–7 моль/л ; pH = 6,99.
Пример 6. Рассчитайте рН раствора ацетата натрия с концентрацией 0,1 моль/л, а также степень протолиза (гидролиза) этой соли. Ка(СН3СООН) = 1,75 ∙10-5.
Решение:
Протолитическое равновесие: CH3COO– + H2O = CH3COOH + OH–
Константа протолиза (константа основности иона ацетата):
Kb = [CH3COOH] [OH–] / [CH3COO–]
[CH3COOH] = [OH–]
а) Для приближенных расчетов можно считать,
что [CH3COO–]равн = [CH3COO–] исх.
б) Для точных расчетов: [CH3COO–]равн = [CH3COO–] исх. – [OH–]
Kb = Kw/ Ka = 10–14 / 1,75 ∙10–5 = 5,75 ∙10–10
а) Kw/Ka = [OH–]2 / [CH3COO–]; [OH–]2 = Kw/Ka [CH3COO–];
2pOH = – lgKw + lgKa – lg[CH3COO–] = – lg10–14 + lg1,75 ∙10–5 – lg0,1= = 10,24.
pOH = 5,12. pH = 14 – 5,12 = 8,88.
б) Kw/Ka = [OH–]2 / ([CH3COO–] исх. – [OH–]);
[OH–]2 = Kw/Ka ([CH3COO–] исх. – [OH–]);
[OH–]2 = 5,75 ∙ 10–10 (0,1 – [OH–]); Пусть [OH–]= x.
x2 + 5,75 ∙10–10 ∙ x – 5,75 ∙10–10 ∙ 0,1 = 0;
x = 7,6 ∙10-6; [OH–] = 7,6 ∙10–6 моль/л; рОН = 5,12; pH = 8,88.
Степень гидролиза соли: h = [OH–] / [CH3COO–] исх. = 7,6 ·10–6 / 10–1 = =7,6 ·10–5 = 0,0076%.
Пример 7. Рассчитайте рН в растворе гидрокарбоната натрия с концентрацией соли с= 0,1моль/л.
Ka1(H2CO3) = 4,5 ∙10–7; Ka2(HCO3–) = 5,0∙10–11.
Дата публикования: 2014-10-16; Прочитано: 5709 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
