 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Производные карбоновых кислот, их свойства и взаимные превращения
|
|
Среди производных карбоновых кислот в организме чаще всего встречаются их сложные эфиры (ацилпроизводные спиртов), тиоэфиры (ацилпроизводные тиолов) и амиды (ацилпроизводные аммиака или аминов).
Сложные эфиры и тиоэфиры. Эфиры имеют общую формулу  , а тиоэфиры
, а тиоэфиры 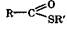 ,
,
где R и R' - углеводородные радикалы. Названия сложных эфиров строятся из названий исходных кислоты и спирта. По систематической номенклатуре общее название сложных эфиров - алкилалканоаты.

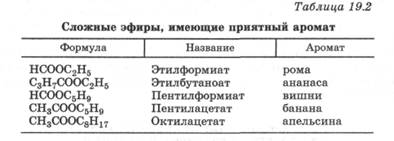
Сложные эфиры широко распространены в живой природе. Многие из них входят в состав цветов, ягод и фруктов, определяя их аромат (табл. 19.2), и используются в пищевой и парфюмерной промышленности. Тиоэфиры также отличает резкий запах, но очень неприятный, который обнаруживается уже в ничтожных концентрациях.
Сложные эфиры, подобно карбоновым кислотам, образуют ассоциат с ионом гидроксония, который в очень кислой среде (> 50 % H2SO4) превращается в катион эфира:

В результате этих процессов происходит активация электрофильного центра на углеродном атоме карбонильной группы сложного эфира, по которому протекают реакции нуклеофильного замещения: гидролиз и ацилирование.
Гидролиз сложных эфиров. Реакция расщепления сложных эфиров на кислоту и спирт при действии воды происходит и в кислой, и в щелочной среде. Однако в присутствии щелочи реакция гидролиза (омыления) необратима, так как получается соль карбоновой кислоты, содержащая устойчивый ацилатанион:

Реакция гидролиза сложных эфиров обратна реакции этерификации.
 |
В отличие от обычных сложных эфиров, карбонильный атом углерода в тиоэфирах несет больший положительный заряд, что делает их более реакционноспособными. Вследствие этого связь С—S в ацилкоферменте А - макроэргическая. При гидролизе ацетилко-фермента А выделяется даже несколько большая энергия, чем при гидролизе АТФ (AG° = -32,9 и -30,5 кДж/моль соответственно):
Это обстоятельство способствует активности ацилкоферментов А в реакциях, протекающих в организме с их участием.
Ацилирование спиртов сложными эфирами. Сложные эфиры взаимодействуют со спиртами с образованием нового сложного эфира. Эта реакция называется переэтерификацией, а в биохимии ее называют реакцией трансацилирования. Реакция трансацилирования обычно катализируется кислотами, и в этих случаях она обратима:

В организме реакция трансацилирования (переэтерификации) катализируется ферментами трансферазами, которые способствуют переносу ацилов от сложных эфиров на спирты, амины и другие субстраты. Источником ацилов обычно являются ацилкоферменты А, т. е. тиоэфиры карбоновых кислот. Одним из примеров реакции трансацилирования является синтез ацетилхолина с помощью ацетилкофермента А:

Ацилирование аминов сложными эфирами. Сложные эфиры взаимодействуют с аммиаком или аминами (реакция аминолиза) с образованием амидов соответствующих карбоновых кислот:

Кроме реакций нуклеофильного замещения (гидролиза и ацилирования) молекулы сложных эфиров вступают в реакции конденсации друг с другом с образованием связи С—С. В образовании новой связи участвуют углеродный атом карбонильной группы одной молекулы эфира и а-углеродный атом другой молекулы эфира. Эта реакция конденсации (С-ацилирования) сопровождается окислительно-восстановительными превращениями, и поэтому она будет рассмотрена в разд. 19.2.4, 19.3.3, 19.4.
Амиды  .
.
В молекулах амидов имеет место сопряжение неподеленной электронной пары атома азота с π-системой двойной связи С=0 (р,777 л-сопряжение). В результате связь С—N в амидах становится короче, чем в аминах, а длина связи С=О такая же, как в карбоновых кислотах, где имеет место аналогичное р, π -сопряжение (разд. 19.2.1). Благодаря сопряжению атомы амидной группировки находятся в одной плоскости и вращение по амидной связи С—N в значительной степени заторможено, так как эта связь имеет частично характер двойной связи.
 |
Основность амидов [рКа(ВH+) = 0 - -2] выше, чем сложных эфиров [рКа(ВН+) = -5 - -6]. В то же время их основность значительно меньше основности аминов [pKa(BH+) = 5 - 10] ввиду иной гибридизации атомных орбиталей атома азота, способствующей сильному взаимодействию неподеленной электронной пары атома азота с двойной связью карбонильной группы (разд. 23.1). Если в молекуле амида имеется связь N—Н, то возможна его кислотная ионизация. Амиды являются слабыми NH-кислотами (рКа = = 13 - 15), и их кислотность сравнима с кислотностью спиртов (разд. 17.2):.
Реакции нуклеофильного замещения. Амиды в присутствии щелочи или кислоты легко гидролизуются:

В кислой среде вследствие протонирования молекула амида активируется и может ацилировать спирты, образуя сложный эфир карбоновой кислоты и амин:

Реакции с электрофильными реагентами. Электрофильные реагенты атакуют в амидах кислородный атом карбонильной группы. Так, при нагревании амидов с сильными электрофилами (Р205, РОС13) происходит внутримолекулярное отщепление молекулы воды с образованием нитрилов карбоновых кислот:

Нитрилы  Нитрилы являются очень слабыми N-ocнованиями [рКа(ВН+) = -10], поскольку их атом азота имеет sр-гибридизацию. Поэтому он более электроотрицателен и значительно сильнее удерживает свою неподеленную электронную пару, чем атом азота в других азотсодержащих соединениях (разд. 23.1).
Нитрилы являются очень слабыми N-ocнованиями [рКа(ВН+) = -10], поскольку их атом азота имеет sр-гибридизацию. Поэтому он более электроотрицателен и значительно сильнее удерживает свою неподеленную электронную пару, чем атом азота в других азотсодержащих соединениях (разд. 23.1).
Нитрилы легко подвергаются гидратации в кислой или щелочной среде за счет нуклеофильного присоединения воды к сильнополярной тройной связи  с образованием амида соответствующей кислоты:
с образованием амида соответствующей кислоты:

Ацилирующего действия нитрилы не проявляют. Подобно другим производным карбоновых кислот нитрилы за счет a-водородного атома являются слабыми С—Н-кислотами, образующими карбанион на a-углеродном атоме. Такой карбанион легко присоединяется к карбонильным соединениям по реакции типа альдольной конденсации.
Взаимные превращения производных карбоновых кислот. Рассмотренные производные карбоновых кислот склонны к взаимопревращениям за счет реакций нуклеофильного замещения у карбонильного углеродного атома. Это отражено на рис. 19.1. На схеме указаны типовые реагенты, при помощи которых из карбоновой кислоты могут быть получены ее производные. Реагенты, отмеченные кружком, позволяют получить

Рис. 19.1. Схема получения производных карбоновых кислот и их превращений
соответствующие им ацилпроизводные из любых других, расположенных на схеме правее. Наиболее реакционноспособны галогенангидриды карбоновых кислот (ацилгалогениды), которые можно превратить в ангидриды, сложные эфиры или амиды обработкой их или солью кислоты, или спиртом, или аммиаком соответственно. Ангидриды кислот легко превращаются в сложные эфиры или амиды. В организме галогенангидриды или ангидриды карбоновых кислот не встречаются. Ацил-коферменты А по ацилирующей способности близки к ангидридам кислот. В организме они легко превращаются в сложные эфиры или амиды. Сложные эфиры действием аммиака или амина превращаются в амиды.
Дата публикования: 2014-10-16; Прочитано: 4569 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
