 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Пример 2. Построить кривую титрования 100 мл 0,1 н
|
|
Построить кривую титрования 100 мл 0,1 н. раствора Cu2SO4 0,1 н. раствором K2Cr2O7 в 1 н. H2SO4, температура опыта 20 °С.
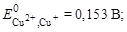
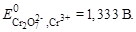
Решение: 1. Составим ионно-молекулярное уравнение окислительно-восстановительной реакции:
| Сu+ ó Cu2+ + e – | ´6 | |
 + 14 H+ + 6 e – ó 2Cr3+ + 7H2O + 14 H+ + 6 e – ó 2Cr3+ + 7H2O
| . |
6Cu+ +  + 14 H+ = 6Cu2+ + 2Cr3+ + 7H2O
+ 14 H+ = 6Cu2+ + 2Cr3+ + 7H2O
2. Рассчитаем потенциалы в процессе титрования, используя уравнение Нернста. До ТЭ (избыток Cu+) потенциалопределяющей является реакция:
Cu+ ó Cu2+ + e–:
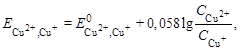
 .
.
Для расчета потенциала нужно знать молярные концентрации окисленной (Cu2+) и восстановленной (Cu+) форм вещества. Для примера рассчитаем С(Сu2+) и C(Cu+) для точки, когда прилито 10 мл раствора K2Cr2O7 (без учета разбавления раствора).
С (Сu2+) = 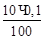 = 10–2 моль/л; С (Сu+) = 0,1 – 0,01 = 0,09 моль/л,
= 10–2 моль/л; С (Сu+) = 0,1 – 0,01 = 0,09 моль/л,
тогда
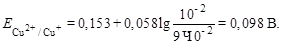
| Объем раствора K2Cr2O7, мл | 99,9 | ||||
| С (Сu2+), моль/л | 0,01 | 0,05 | 0,09 | 0,099 | 0,0999 |
| C (Cu+), моль/л | 0,09 | 0,05 | 0,01 | 0,001 | 0,0001 |
| Е (Сu2+, Cu+), В | 0,098 | 0,153 | 0,211 | 0,269 | 0,327 |
3. Рассчитаем потенциал в ТЭ:
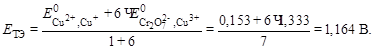
4. Рассчитаем потенциал после ТЭ, когда в избытке  и протекает реакция:
и протекает реакция:
 + 14 H+ + 6 e – ó 2Cr3+ + 7H2O
+ 14 H+ + 6 e – ó 2Cr3+ + 7H2O
Концентрация Cr3+ считаем постоянной и равной 0,1 моль/л.
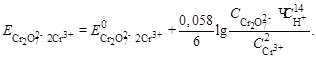
Считаем, что С (Н+) = 1 моль/л.
| Объем раствора K2Cr2O7, мл | 100,01 | 100,1 | |
 , моль/л , моль/л
| 10–5 | 10–4 | 10–3 |
| C (Cr3+), моль/л | 0,1 | 0,1 | 0,1 |
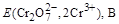
| 1,301 | 1,314 | 1,323 |
Для примера рассчитаем Е для точки, когда прилито 100,01 мл K2Cr2O7 (без учета разбавления):
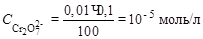

Потенциометрическое титрование по методу осаждения
В качестве индикаторных электродов в методе осаждения используют металлические серебро и ртуть, что позволяет определять концентрацию ионов серебра и ртути  , а также
, а также 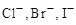 и др. ионы, которые образуют с ионами серебра и ртути малорастворимые соединения.
и др. ионы, которые образуют с ионами серебра и ртути малорастворимые соединения.
Электродами сравнения служат каломельный или хлорсеребряный электроды, контакт которых с исследуемым раствором осуществляется при помощи электролитического ключа с KNO3.
Рассмотрим титрование галогенид-ионов ионами серебра с серебряным индикаторным электродом. В растворе идет химическая реакция:
Ag+ + Hal–= Ag Hal(тв.), Кs(AgHal) = [Ag+] × [Hal–].
До точки эквивалентности потенциал электрода вычисляют по формуле:
 .
.
Концентрацию ионов Ag + рассчитываем из произведения растворимости Ks: 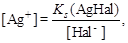 тогда
тогда
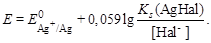
В точке эквивалентности [Ag+] = [Hal – ] = 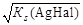 и потенциал электрода:
и потенциал электрода:

После ТЭ потенциал электрода рассчитывают по уравнению:
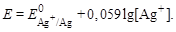
Пример
Рассчитать потенциалы серебряного электрода при титровании 0,1 н. раствора KSCN 0,1 н. раствором AgNO3 до начала титрования, в ТЭ, а также величину скачка потенциала в ТЭ.
Решение: 1. Уравнение реакции осаждения:
Ag+ + SCN– = AgSCN(тв.), Ks = 1 × 10–12.
Определяем потенциал серебряного электрода до титрования:
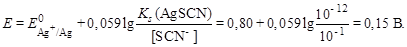
В точке эквивалентности:
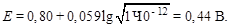
В начале скачка потенциала [SCN–] = 10–4 моль/л, так как недотитровано 0,1 % KSCN:
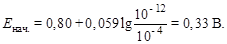
В конце скачка потенциала [Ag+] = 10–4 моль/л, так как избыток AgNO3 (0,1 н.) составляет 0,1 %. Тогда Е кон. = 0,80 + 0,059× lg 10–4 = = 0,564 В.
Скачок потенциала равен Е кон. – Е нач. = 0,564 – 0,33 = 0,234 В.
5. Кондуктометрический метод анализа
Кондуктометрический метод анализа или кондуктометрия основана на измерении электропроводности растворов.
Электропроводность g – это величина обратная сопротивлению R.
Удельная электропроводность s представляет собой электропроводность 1 см3 раствора, находящегося между параллельными электродами, площадью 1 см2 каждый, расположенными на расстоянии 1 см.
Молярная электропроводность l – это электрическая проводимость раствора, содержащего 1 моль вещества, если раствор помещен между двумя параллельными электродами, расположенными на расстоянии 1 см.
Для решения задач рекомендуем использовать таблицу основных величин, применяемых в кондуктометрии (см. таблицу).
Дата публикования: 2014-11-18; Прочитано: 1046 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
