 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Пример 2. Определить удельную и молярную электропроводности 0,04 М раствора нитрата серебра в ячейке с круглыми электродами диаметром 1,2 см и расстоянием между ними
|
|
Определить удельную и молярную электропроводности 0,04 М раствора нитрата серебра в ячейке с круглыми электродами диаметром 1,2 см и расстоянием между ними 1,5 см. К ячейке приложено напряжение 0,6 В. Сила тока 5 мА.
Решение: для определения удельной электропроводности воспользуемся формулой:
 .
.
Рассчитаем площадь электрода: 
Рассчитаем сопротивление проводника:
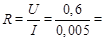 120 Ом.
120 Ом.
Подставим величины l, S и R в формулу:
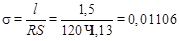 Ом–1×см–1.
Ом–1×см–1.
Определяем молярную электропроводность:
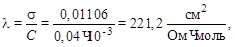
где С – концентрация раствора, моль/см3.
6. Кулонометрический метод анализа
Кулонометрический метод анализа основан на законе Фарадея, согласно которому количество прореагировавшего вещества прямо пропорционально количеству электричества, прошедшего через электрохимическую систему.
Математическая запись закона Фарадея:

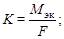

где К – электрохимический эквивалент, г/Кл; m – масса вещества, участвующего в электрохимических превращениях на электроде, г; Q – количество электричества, Кл; Q = I×t (где I – ток, А; t – время, с);
М эк – молярная масса эквивалента, г/моль; М эк = МА/n (где МА – молярная масса атома элемента, г/моль; n – валентность элемента);
F – постоянная Фарадея; F = 96500 Кл/моль-экв. = 26,8 А×ч/моль-экв.
Пример
При кулонометрическом титровании 10 мл бихромата калия раствором, содержащим железо (II), на восстановление 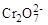 потребовалось 25 минут, при силе тока 100 мА. Определите С эк раствора бихромата калия.
потребовалось 25 минут, при силе тока 100 мА. Определите С эк раствора бихромата калия.
Решение: 1. Определяем количество электричества:
Q = It = 25× 60× 0,1 = 150 Кл;
2. Определяем количество эквивалентов K2Cr2O7
96500 Кл – 1 моль-экв
150 Кл – х х = 150/96500 = 0,0015 моль-экв.
3. Определяем С эк раствора
0,0016 моль-экв – 10 мл
С эк – 1000 мл С эк = 0,16 моль/л.
7. Полярография и амперометрия
Пример 1. При полярографировании стандартных растворов свинца (II) получили следующие результаты:
| С Pb×106,г/мл | 0,25 | 0,50 | 0,75 | 1,0 | 1,25 |
| h, мм | 2,0 | 4,0 | 6,0 | 8,0 | 10,0 |
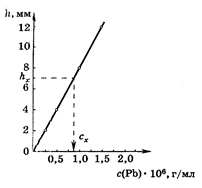 Навеску алюминиевого сплава массой 4,848 г растворили и раствор разбавили до 50,00 мл. Высота полярографической волны свинца в полученном растворе оказалась равной hх = 7,0 мм.
Навеску алюминиевого сплава массой 4,848 г растворили и раствор разбавили до 50,00 мл. Высота полярографической волны свинца в полученном растворе оказалась равной hх = 7,0 мм.
Вычислите массовую долю (%) свинца в образце.
Решение. Строим градуировочный график (см. рисунок) в координатах h – C Pb.
По графику находим Сх =
= 0,87×10–6 г/мл, соответствующую
hx = 7,0 мм, и рассчитываем массовую долю (%) свинца в сплаве:
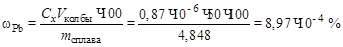
Пример 2. При амперометрическом титровании 10,00 мл раствора сульфата цинка с Т (ZnSO4/Zn) = 3,00×10–4 мг/мл поместили в мерную колбу вместимостью 50,00 мл и довели водой до метки. Аликвоту полученного раствора (10,00 мл) оттитровали раствором K4[Fe(CN)6)]. Результаты титрования:
| V (K4[Fe(CN)6], мл | 0,0 | 0,2 | 0,4 | 0,6 | 0,8 | 1,0 | 1,2 | 1,4 | 1,6 |
| Id, мА |
Вычислить условный титр раствора K4[Fe(CN)6] по цинку.
Решение. Строим кривую амперометрического титрования (рисунок) в координатах Id –V (K4[Fe(CN)6]) и находим, что в точке эквивалентности объем титранта равен: V (K4[Fe(CN)6]) = 1 мл.
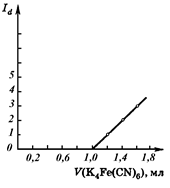 Вычисляем условный титр раствора K4[Fe(CN)6 по цинку:
Вычисляем условный титр раствора K4[Fe(CN)6 по цинку:


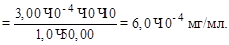
Пример 3. Навеску сульфата кобальта массой 2,500 г растворили, добавили НCl, желатину, пиридин и довели водой до метки в колбе на 100 мл.
Аликвоту раствора объемом 50,0 мл полярографировали и получили диффузионный ток 1,35 мкА. Затем в полярографическую ячейку добавили 5,00 мл стандартного раствора, содержащего 10–2 моль/л NiCl2, и получили диффузионный ток 3,8 мкА. Вычислить массовую долю (%) Ni в образце.
Решение. В соответствии с уравнением Ильковича
I 1 = kC 1; I 2 = kC 2,
где I 1, I 2 – диффузионные токи до и после прибавления стандартного раствора; С 1 – начальная концентрация никеля, С 2 – концентрация никеля после добавления стандартного раствора.
Если С ст – концентрация стандартного раствора, V – начальный объем раствора в полярографической ячейке, V ст– объем прибавленного стандартного раствора, то
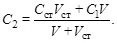
Отношение I 1 /I 2 = c 1/ c 2 преобразуем относительно с 1:
 , или
, или  .
.
Подставляем числовые значения:
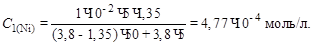
Массовая доля (%) никеля равна:
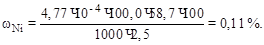
8. Хроматографический метод анализа
Метод заключается в предварительном разделении исследуемой смеси веществ на отдельные компоненты при пропускании ее через слой сорбента.
Качественный хроматографический анализ сводится к обнаружению компонентов смеси путем «проявления» – окрашивания пятен хроматограммы реагентами – проявителями. Количественный хроматографический анализ показывает содержание компонентов или по площади их пятен на хроматограмме, или по высоте в осадочной хроматографии, или по площади пиков в газожидкостной хроматографии.
Важной характеристикой ионитов в ионообменной хроматографии является значение их обменной емкости. Обменная емкость – число миллимоль эквивалентов поглощенных ионов, приходящееся на 1 г сухого ионита или 1 мл набухшего ионита (ммоль/г, ммоль/мл). В статических условиях – это статическая обменная емкость. В динамических условиях может быть определена полная динамическая обменная емкость (ПДОЕ):
- емкость ионита при полном его насыщении поглощенными ионами, а также динамическая обменная емкость (ДОЕ);
- емкость ионита до проскока поглощаемых ионов.
Пример 1 (качественный хроматографический анализ).
Смесь катионов, содержащихся в молоке, при разделении в тонком слое оксида алюминия с помощью ацетона, содержащего 12 % воды и 12 % конц. HCl, дала после проявления K4[Fe(CN)6] три пятна со значениями Rf 0,37; 0,66; 0,79 соответственно.
Пробы катионов-свидетелей, помещенных на ту же пластинку, дали Rf Ni2+ – 0,37; Co2+ – 0,54; Cu2+ – 0,67; Fe3+ – 0,79. Определить катионы, входящие в состав молока.
Решение: Rf – коэффициент пробега, равный отношению длины пробега данного вещества от стандартной линии до центра пятна к длине пробега растворителя. Rf всегда меньше 1. Так как одинаковые вещества имеют в одних и тех же условиях разделения одинаковый Rf, то сравнивая длину пробега веществ-свидетелей и пятен компонентов смеси, можно сделать вывод о присутствии в смеси веществ, идентичных свидетелям.
Следовательно, в смеси присутствуют катионы: Ni2+, Cu2+, Fe3+.
Пример 2, 3, 4, 5 (количественный хроматографический анализ).
Дата публикования: 2014-11-18; Прочитано: 1520 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
