 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Пример 1. Для гальванического элемента (ГЭ), составленного из стандартного водородного электрода и цинкового электрода в 10–3М растворе ZnSO4 при 25 °С обозначьте ГЭ
|
|
Для гальванического элемента (ГЭ), составленного из стандартного водородного электрода и цинкового электрода в 10–3М растворе ZnSO4 при 25 °С обозначьте ГЭ, запишите уравнения электродных процессов, уравнение суммарной реакции. Рассчитайте равновесное напряжение.
Решение: 1. Для обозначения ГЭ определяем потенциалы электродов: 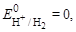 а
а 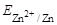 рассчитываем по уравнению Нернста:
рассчитываем по уравнению Нернста:

где Е 0 – стандартный электродный потенциал; R – универсальная газовая постоянная (8,31 Дж/моль×К); F – число Фарадея (96500 Кл/моль-экв); n – число электронов, участвующих в процессе.
В разбавленных растворах активность ионов а можно считать равной концентрации С. Значение коэффициента 2,3 RT/F при температуре 25 °С равно 0,059.
Так как 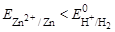 , то цинковый электрод будет анодом.
, то цинковый электрод будет анодом.
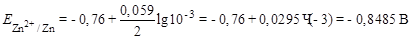 .
.
2. Обозначим ГЭ
А(–) ZnïZn2+ïï2H+ïH2ïPt (+)K.
3. Электродные процессы:
на аноде Zn° = Zn2+ + 2 e –
на катоде 2Н+ + 2 е – = Н2.
4. Уравнение суммарной реакции:
Zn + 2H+ = Zn2+ + H2 (ионно-молекулярная форма);
Zn + H2SO4 = ZnSO4 + H2 (молекулярная форма).
4. Рассчитаем напряжение ГЭ:
Е = Е (+) – Е (–) = 0 – (– 0,8485) = 0,8485 В.
Дата публикования: 2014-11-18; Прочитано: 663 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
