 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Пример 2. Напишите реакцию и рассчитайте напряжение ГЭ, составленного из двух электродов:
|
|
Напишите реакцию и рассчитайте напряжение ГЭ, составленного из двух электродов:
Agï AgCl(к)ïKCl (0,04 M) и Н+ (0,007 М)ï H2(0,4 атм) ïPt
Решение: 1. Рассчитаем электродные потенциалы.
Потенциал водородного электрода:

Потенциал хлорсеребряного электрода:
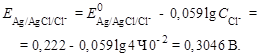
2. Рассчитаем напряжение: так как 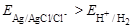 , поэтому хлорсеребряный электрод – катод.
, поэтому хлорсеребряный электрод – катод.
Е = Е (+) – Е (–) = 0,3046 – (– 0,120) = 0,4246 В.
3. Для составления уравнения реакции в ГЭ запишем уравнения электродных процессов:
| А: Н2 = 2Н+ + 2 е – | |
| К: AgCl + e – = Ag + Cl– | ´2. |
Уравнение реакции:
2 AgCl + H2 = 2Ag + 2Cl– + 2 H+.
4.2. Потенциометрическое определение
рН – прямая потенциометрия
Мерой концентрации ионов водорода в растворе служит водородный показатель рН =  .
.
При расчете рН необходимо вначале найти величину Е гэ, составленного из индикаторного электрода и электрода сравнения. В качестве индикаторного электрода используют электроды, потенциал которых зависит от рН раствора. Это водородный, хингидронный и стеклянный электроды.
Электроды сравнения – стандартный водородный, каломельный и хлорсеребряный. Величина потенциала электродов сравнения остается неизменной при изменении рН раствора. Потенциалы электродов см. в приложении 3.
Дата публикования: 2014-11-18; Прочитано: 1062 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
