 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Пример 2. Вычислить рН раствора по следующим данным: индикаторный электрод – хингидронный, электрод сравнения – хлорсеребряный (х.с.) в 1 н
|
|
Вычислить рН раствора по следующим данным: индикаторный электрод – хингидронный, электрод сравнения – хлорсеребряный (х.с.) в 1 н. растворе KCl, Е гэ = 0,20 В, t = 25 °С.
Решение: Е х.с.(1 н. KCl) = 0,22 В (см. приложение 3);
Е хингид. = Е °хингид. – 0,059× рН = 0,70 – 0,059×рН.
Так как Е хингидр.> Е х.с., то хлорсеребряный электрод в гальваноцепи играет роль анода, а хингидронный – катода.
Е = Е (+) – Е (–) = Е хингидр. – Е х.с.; 0,2 = 0,7 – 0,059 ×рН –0,22,
отсюда 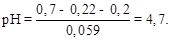
4.3. Потенциометрическое титрование
Титрование, при котором точка эквивалентности (ТЭ) (в которой количество эквивалентов определяемого вещества и титранта равны) определяется по скачку потенциала индикаторного электрода, называется потенциометрическим.
Дата публикования: 2014-11-18; Прочитано: 2078 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
