 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Зависимость давления насыщенного пара от температуры
|
|
Давление насыщенного пара жидкости резко увеличивается с ростом Т; эта зависимость дается уравнением:
dP = 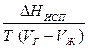 dT,
dT,
а вдали от критической Т: d ln P = 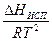 dT
dT
Если интервал температур небольшой и DНисп можно считать постоянной, то
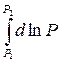 =
= 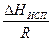
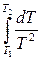 , ln
, ln  =
= 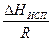 (
( –
– 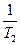 ) =
) = 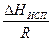 ×
× 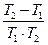
Мы получили уравнение для расчета DНисп, зная Р2 при Т2 и Р1 при Т1.
Представим в виде неопределенного интеграла:
ln P = – 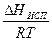 + const =
+ const = 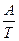 + B
+ B
Это – уравнение прямой в координатах ln P – 1/Т. DНисп можно найти по графику:
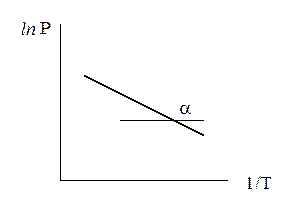
| tg a = A = – DНисп / R Вышеприведенные формулы справедливы для узкого интервала температур, далеких от критической: во-первых, DНисп зависит от Т; во-вторых, насыщенный пар при высоких Т нельзя считать идеальным газом. Поэтому уравнение, охватывающее зависимость Р = f (T) в широком интервале Т, неизбежно становится эмпирическим. |
Такое уравнение может быть получено путем применения уравнения Кирхгоффа к процессу парообразования.
 = Cнас. п. – Сж» DСР
= Cнас. п. – Сж» DСР
(Cнас. п. Можно заменить на СР при не очень высоких Р).
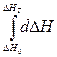 =
= 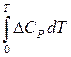 , DНТ = DНо +
, DНТ = DНо + 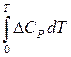
(DНо – теплота испарения при 0 К). Подставим вышеприведенное уравнение в уравнение: d ln P = 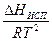 dT
dT
ò d ln P = ò 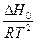 dT + ò
dT + ò 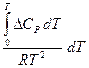
ln P = – 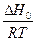 +
+ 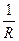 ò
ò 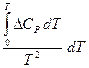 + j
+ j
j – постоянная интегрирования. DНо и j могут принимать различные значения в зависимости от точности используемых данных по СР. Если DСР известно точно и в широком интервале Т (что выполняется редко), то j определяется однозначно и называется истинной химической постоянной.
DНТ = DНо + a T + b T2 + c T3 + …
Подставим это выражение в то же самое уравнение:
d ln P = 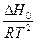 dT +
dT +  dT +
dT + 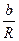 dT +
dT + 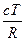 dT + …
dT + …
ln P = – 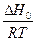 +
+  ln T +
ln T + 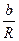 T +
T + 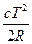 + … + const
+ … + const
lg P = – 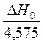 ×
× 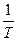 +
+  lg T +
lg T +  T + … + const¢
T + … + const¢
(const¢ = const /2,303 – переход от ln к lg; такие числовые значения получаются, если R выражено в калориях). Это уравнение было приведено Нернстом; он его упростил:  = 1,75; b = – e
= 1,75; b = – e
lg P = – 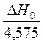 ×
× 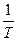 + 1,75 lg T –
+ 1,75 lg T – 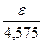 T + i
T + i
i – условная химическая постоянная. Величины DНо, e и i подбираются эмпирически; это менее точное уравнение, чем уравнение, в которое входит j. Величина i для многих веществ с двух- и многоатомными молекулами» 3 (если Р – в атм).
Кривые давления насыщенного пара можно экстраполировать к высоким Р и Т методами сравнительного расчета. Эти методы основаны на подобии кривых, выражающих зависимость давления пара жидкостей от Т (особенно жидкостей, близких по химическим свойствам и Ткип). За стандартную выбирается одна из жидкостей (например, вода), давление пара которой хорошо изучено.
Закон смещения равновесия (правило подвижного равновесия)
Дата публикования: 2015-11-01; Прочитано: 456 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
