 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
U – изохорно-изэнтропный термодинамический потенциал
|
|
H = U + PV
dH = dU + PdV + VdP, dU £ TdS – PdV
dH £ TdS + VdP, H = H (S,P)
dH =  dS +
dS + 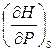 dP;
dP;  = T,
= T, 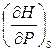 = V
= V
Т – мера приращения Н с ростом S при P = const
V – мера приращения H с ростом P при S = const.
При S,P = const: (¶H)S,P £ 0
(¶H)S,P < 0 – критерий направления процесса в условиях S,P = const;
(¶H)S,P = 0, (¶ 2H)S,P > 0 – критерий достижения равновесия.
Н – изобарно-изэнтропный потенциал.
U, Н – эти функции могут служить критерием равновесия при S = const. S непосредственно измерить нельзя, и контроль ее постоянства при неравновесных процессах затруднителен. Поэтому функции U и Н не находят широкого применения в качестве критериев направления процесса и равновесия.
Сопоставим выражения для полных дифференциалов функций U, H, F и G:
| dU = TdS – PdV dH = TdS + VdP dF = – SdT – PdV dG = – SdT + VdP | Эти выражения образуют замкнутую группу, в которой две пары переменных – Т и S (параметры, связанные с теплотой) и Р и V (параметры, связанные с работой) дают все возможные сочетания. В зависимости от характера изучаемого процесса может быть использована та или иная из этих функций. |
Частными производными этих четырех функций при данном, характерном для каждой из них наборе независимых переменных являются основные параметры состояния системы: Р, V, T, S. Отсюда вытекает важное свойство этих функций: через каждую из этих функций и ее производные можно выразить в явной форме любое термодинамическое свойство системы. Каждая функция дает, таким образом, полную термодинамическую характеристику системы. Поэтому эти функции (термодинамические потенциалы) называют характеристическими функциями.
Каждая функция обладает свойствами характеристической функции только при соответствующем, характерном для нее наборе независимых переменных. Поэтому независимые переменные в вышеприведенных уравнениях называют естественными переменными.
Энтропию также можно отнести к этим функциям (может служить критерием направления процесса и достижения равновесия):
dQ = dU + dA £ TdS, TdS ³ dU + PdV, S = S (U,V)
(¶S)U,V > 0 – критерий самопроизвольного протекания процесса в условиях U,V = const;
(¶S)U,V = 0, (¶ 2S)U,V < 0 – критерий равновесия.
Т.о., условия равновесия системы можно сформулировать следующим образом: в состоянии равновесия системы ее термодинамические потенциалы имеют минимальное значение при постоянстве своих естественных переменных, а энтропия имеет максимальное значение. Другое общее свойство термодинамических потенциалов – то, что убыль их в равновесном процессе при постоянстве естественных переменных равна максимальной полезной работе.
Лекция 7
Уравнения Гиббса-Гельмгольца. Статистический характер второго закона термодинамики.
Дата публикования: 2015-11-01; Прочитано: 239 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
