 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Расчеты при обратном титровании
|
|
Расчет проводят по формулам, имеющим несколько иной вид, чем при расчетах при прямом титровании.
В этом случае расчет сводится к определению:
1) количества эквивалентов стандартного раствора вещества В (n Э,B), затраченного с избытком на реакцию с определяемым веществом А:
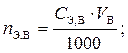
2) количества эквивалентов определяемого вещества В1 (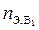 ), пошедшего на титрование избытка вещества В:
), пошедшего на титрование избытка вещества В:
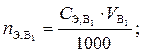
3) количества эквивалентов вещества А (n Э,A), равного количеству эквивалентов основного вещества В, прореагировавших с определяемым веществом А:
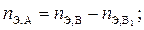
4) количества вещества А в граммах:
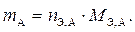
Подставив значения n В, 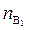 в формулу, выражающую значение m A, получим
в формулу, выражающую значение m A, получим
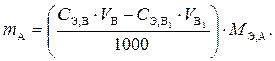
Если велось определение всего объема анализируемого раствора, то процентное содержание анализируемого вещества находится по формуле

Если велось определение аликвотной части, то формула имеет вид
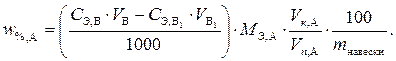
Пример 1. Рассчитать массовую долю 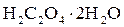 в анализируемом образце, если на титрование раствора, содержащего 0,1650 г образца, израсходовано 25,00 см3 0,1 н раствора NaOH.
в анализируемом образце, если на титрование раствора, содержащего 0,1650 г образца, израсходовано 25,00 см3 0,1 н раствора NaOH.
Решение. 1. Рассчитаем мольную массу эквивалента щавелевой кислоты  . Щавелевая кислота – двухосновная кислота, следовательно, эквивалентная масса будет определяться как
. Щавелевая кислота – двухосновная кислота, следовательно, эквивалентная масса будет определяться как
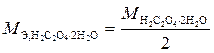 ,
,
где 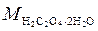 – мольная масса, г/моль.
– мольная масса, г/моль.
 г/моль.
г/моль.
2. Рассчитаем массу щавелевой кислоты по формуле
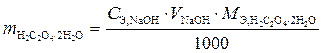 .
.
Эта формула была выведена из закона эквивалентов и формулы нахождения мольной массы эквивалентов.
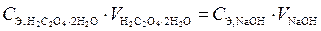 ;
;
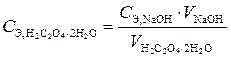 ,
,
а 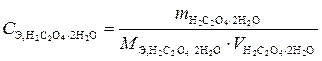 , подставляем эту формулу в выражение закона эквивалентов:
, подставляем эту формулу в выражение закона эквивалентов:
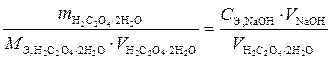 ;
;
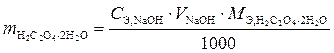 ,
,
где множитель 1000 вводится для перевода объема из см3 в дм3.
 г.
г.
3. Рассчитаем массовую долю щавелевой кислоты в образце
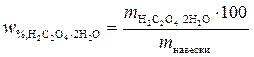 ,
,
где m навески – навеска образца, г.
Отсюда
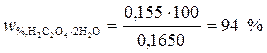 .
.
Ответ. Массовая доля щавелевой кислоты в образце составляет 94 %.
Пример 2. Навеску борной кислоты массой 0,6 г растворили в мерной колбе вместимостью 100,00 см3. На титрование 20,00 см3 полученного раствора израсходовали 18,34 см3 0,1 н гидроксида натрия (NaOH), поправочный коэффициент K = 0,9850. Определить содержание борной кислоты.
Решение. Содержание борной кислоты (%) в образце определим
по формуле
 ,
,
где 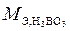 – эквивалентная масса борной кислоты, г/моль;
– эквивалентная масса борной кислоты, г/моль;
Vк – объем колбы, в данном примере Vк = 100 см3;
Vп – объем аликвоты, в данном примере Vп = 20 см3;
m навески – масса борной кислоты, взятая для анализа, г;
C Э, NaOH – эквивалентная концентрация NaOH, равная 0,1 н;
K NaOH – поправочный коэффициент к стандартному раствору NaOH, равный 0,9850;
V NaOH – объем стандартного раствора NaOH, равный 18,34 см3.
Прежде чем подставить имеющиеся данные в соответствующую формулу, рассчитаем эквивалентную массу борной кислоты.
Борная кислота – трехосновная кислота, следовательно, эквивалентная масса будет определяться как
 ,
,
где 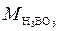 – мольная масса, г/моль.
– мольная масса, г/моль.
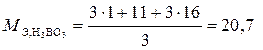 г/моль.
г/моль.
Подставим данные в формулу расчета массового содержания:
 .
.
Ответ. В образце содержится 46,67 % борной кислоты.
Пример 3. К 0,1500 г известняка, содержащего кроме CaCO3 примеси, не реагирующие с кислотой, добавили 20,00 см3 0,206 н раствора соляной кислоты (HCl), после чего избыток кислоты оттитровали 5,60 см3 0,1 н (K = 0,9750) раствором гидроксида натрия (NaOH). Определить процентное содержание CO2 в известняке.
Решение. В этом определении использован метод обратного титрования, в котором для вычисления процентного содержания используется следующая зависимость:
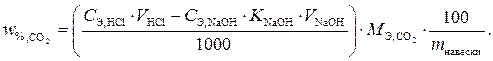
Прежде чем подставить имеющиеся данные в условие задания, рассчитаем эквивалентную массу оксида углерода (CO2). При определении эквивалентной массы оксида удобно пользоваться формулой
М э,оксида = М э,эл. + 8,
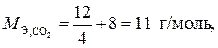
где 12 – атомная масса элемента – углерода;
4 – валентность углерода в оксиде CO2.
Теперь, зная все необходимые значения, подставляем их в формулу расчета 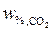 :
:
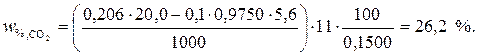
Ответ. В образце известняка содержится 26,2 % углекислого газа.
***
44. Навеска кальцита 1,5780 г растворена в 50,00 см3 0,1 н соляной кислоты. По окончании реакции раствор переведен в мерную колбу на 500,0 см3 и доведен до метки. На титрование 50,00 см3 полученного раствора расходуется 23,45 см3 0,1 н раствора NaOH. Вычислить массовое содержание
СаСО3 в образце (%).
45. На титрование 0,1025 г карбоната натрия с метилоранжем потребовалось 19,30 см3 0,1 н раствора соляной кислоты ( ). Вычислить процентное содержание
). Вычислить процентное содержание 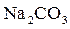 .
.
46. На титрование раствора фосфорной кислоты с метилоранжем затрачено 9,15 см3 0,1 н раствора гидроксида натрия. Какое количество граммов  содержалось в растворе?
содержалось в растворе?
47. В мерной колбе емкостью 500,0 см3 приготовлен раствор из навески 2,1060 г каустической соды, и объем раствора доведен до метки. На титрование 25,00 см3 полученного раствора расходуется 24,50 см3 0,1 н раствора соляной кислоты (K = 0,9650). Сколько процентов 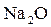 содержится в каустической соде?
содержится в каустической соде?
48. На нейтрализацию раствора, полученного из 0,1822 г купоросного масла, расходуется 30,30 см3 0,1 н (K = 0,9850) раствора гидроксида натрия. Сколько процентов 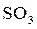 содержал образец купоросного масла?
содержал образец купоросного масла?
49. На титрование раствора, содержащего 3,1580 г гидроксида калия, требуется 27,45 см3 раствора соляной кислоты (K = 0,9545). Сколько процентов 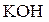 содержал образец, использованный для приготовления раствора?
содержал образец, использованный для приготовления раствора?
50. В мерную колбу емкостью 500,0 см3 помещено 25,00 см3 раствора соляной кислоты ( г/см3), и объем раствора доведен водой до метки. На титрование 20 см3 полученного раствора израсходовано 23,13 см3 0,1 н раствора гидроксида натрия. Вычислить процентное содержание
г/см3), и объем раствора доведен водой до метки. На титрование 20 см3 полученного раствора израсходовано 23,13 см3 0,1 н раствора гидроксида натрия. Вычислить процентное содержание  в исходном растворе кислоты.
в исходном растворе кислоты.
51. На титрование 20,00 см3 раствора  пошло 40,00 см3 0,1 н раствора гидроксида натрия, при этом индикатор фенолфталеин из бесцветной формы перешел в малиновую. Сколько граммов
пошло 40,00 см3 0,1 н раствора гидроксида натрия, при этом индикатор фенолфталеин из бесцветной формы перешел в малиновую. Сколько граммов  содержится в 1 дм3 этого раствора?
содержится в 1 дм3 этого раствора?
52. К раствору 0,7500 г щавелевой кислоты добавлено 10,00 см3 раствора 0,1 н гидроксида калия с поправочным коэффициентом 0,9690, а затем избыток последнего оттитрован 4,02 см3 0,125 н раствором соляной кислоты. Определить процентное содержание 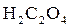 .
.
53. Навеску 0,1032 г карбоната натрия обработали 50,00 см3 0,09496 н раствора соляной кислоты. Избыток кислоты оттитровали 28,80 см3 0,1 н раствора гидроксида калия (K = 1,0250). Вычислить процентное содержание примесей в образце.
54. Навеску фосфорной кислоты массой 0,1182 г растворили в воде и на ее титрование израсходовали 22,18 см3 0,1 н NaOH (K = 0,9519). Определить массовую долю (%) фосфорной кислоты.
55. Вычислить массовую долю (%) свободного SO3 в олеуме, если на титрование 1,2000 г олеума в присутствии метилового оранжевого израсходовано 49,25 см3 0,5202 н NaOH.
56. Навеска мрамора 0,5668 г растворена в 30,00 см3 1,0 н HCl. На титрование избытка HCl израсходовано 14,10 см3 0,8818 н NaOH. Определить массовое содержание примесей в образце (%).
57. Навеска каустической соды 2,1060 г растворена в мерной колбе на 500,0 см3. Полученным раствором титруют 25,00 см3 раствора HCl (K = 0,9850 к 0,1 н), на это расходуется 24,50 см3 раствора анализируемой щелочи. Вычислить массовое содержание Na2O в образце (%).
58. На титрование раствора, полученного разбавлением 1,00 см3 H2SO4 плотностью 1,716 г/см3, расходуется 49,00 см3 раствора NaOH (K = 1,1280 к 0,5 н). Вычислить массовое содержание SO3 в образце (%).
59. Навеска калийной щелочи массой 7,6240 г растворена в мерной колбе на 500,0 см3. На титрование 25,00 см3 полученного раствора расходуется 32,20 см3 0,1 н HCl. Вычислить массовое содержание KОН в образце (%).
60. Навеска серебряного сплава 1,7450 г растворена в азотной кислоте. Раствор разбавлен водой в колбе на 200,0 см3. На титрование 10,00 см3 полученного раствора расходуется 11,75 см3 раствора роданида аммония (K = 0,9344 к 0,05 н). Вычислить массовое содержание серебра в сплаве (%).
61. На титрование раствора, приготовленного растворением 0,0973 г хлорида в произвольном объеме воды, расходуется 28,60 см3 раствора AgNO3 (K = 0,9120 к 0,05 н). Вычислить массовое содержание (%) хлора в образце.
62*. Активным ингредиентом антабуса (применяется для лечения алкоголизма) является дисульфид тетраэтилаурама (М = 296 г/моль).
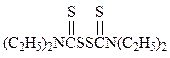
Серу, содержащуюся в 0,432 г препарата, окислили до SO2, который поглотили раствором пероксида водорода (напишите уравнение реакции). На титрование образовавшейся серной кислоты затратили 22,1 см3 0,0373 н раствора основания. Рассчитать массовую долю активного ингредиента.
63*. Навеску образца серосодержащего органического соединения массой 0,121 г сожгли в токе кислорода, а выделившийся газообразный продукт поглотили раствором H2O2, образовавшееся вещество оттитровали 20,5 см3 0,107 н раствора KOH. Напишите уравнения протекающих реакций и рассчитайте массовую долю серы в исходном органическом соединении.
64*. В коническую колбу перенесли навеску чистого гексацианоферрата (III) калия массой 1,015 г, добавили иодид калия и хлороводородную кислоту. Для полноты протекания реакции прилили раствор сульфата цинка (в результате образовался осадок гексацианоферрата (III) цинка) и на титрование выделившегося йода затратили 20,14 см3 раствора тиосульфата натрия. Определите молярную концентрацию тиосульфата натрия и его титр.
Дата публикования: 2015-10-09; Прочитано: 8527 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
