 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Произведение растворимости. Условия образования осадков
|
|
При осаждении или растворении веществ образуется гетерогенная система, состоящая из двух фаз – насыщенного раствора малорастворимого вещества и его осадка. Между раствором и осадком устанавливается динамическое равновесие, которое определяется двумя процессами – осаждением и растворением. В насыщенном растворе малорастворимого электролита устанавливается равновесие между осадком (твердой фазой) электролита и ионами электролита в растворе, например:
 .
.
осадок раствор
Этот равновесный процесс характеризуется константой равновесия, которая для предлагаемого процесса выражается следующим уравнением:
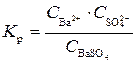 .
.
Знаменатель этой дроби, т. е. концентрация твердого сульфата бария, есть величина постоянная, тогда произведение  тоже является при данной температуре константой. Отсюда следует, что произведение концентраций ионов
тоже является при данной температуре константой. Отсюда следует, что произведение концентраций ионов 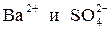 представляет собой постоянную величину, называемую произведением растворимости и обозначаемую ПР:
представляет собой постоянную величину, называемую произведением растворимости и обозначаемую ПР:
 .
.
Произведение растворимости – это произведение активностей ионов малорастворимого электролита в его насыщенном растворе. При данной температуре эта величина постоянная.
В общем виде для электролита типа AmBn
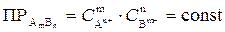 .
.
Значения произведений растворимости некоторых веществ представлены в таблице 3.
Осадок выпадает в том случае, если произведение концентраций ионов больше произведения растворимости  <
<  .
.
Если  >
>  , осадок не выпадает; не выпадает осадок
, осадок не выпадает; не выпадает осадок
и в том случае, если эти величины равны.
Зная величину произведения растворимости, можно рассчитать растворимость осадка (S) по общей формуле:
 , моль/дм3.
, моль/дм3.
Растворимость осадка состава AB вычисляют по формуле
 .
.
Растворимость осадка состава A2B или AB2 рассчитывают по формуле
 .
.
Таблица 3
Произведение растворимости малорастворимых
веществ при 25 °С
| Соединение | ПР | рПР* | Соединение | ПР | рПР* |
| AgBr AgCl Ag2CO3 Ag2CrO4 BaSO4 BaCO3 BaCrO4 CaCO3 CaC2O4 CaCrO4 | 5,3∙10–13 1,8∙10–10 6,2∙10–12 1,1∙10–12 1,8∙10–10 4,9∙10–9 2,0∙10–10 4,8∙10–9 2,6∙10–9 7,0∙10–9 | 12,28 9,75 11,21 11,96 9,75 8,31 9,70 8,32 8,59 8,15 | CaSO4 Ca3(PO4)2 Mg(OH)2 SrSO4 PbSO4 PbI2 PbCl2 PbCrO4 Pb3(PO4)2 HgS | 9,1∙10–6 2,0∙10–29 5,0∙10–12 3,2∙10–7 2,2∙10-8 1,1∙10–9 1,7∙10–5 1,8∙10–14 7,9∙10–43 1,6∙10–52 | 5,04 28,70 11,3 6,50 7,66 8,96 4,77 13,75 42,10 51,80 |
* рПР = –lg ПР.
Растворимость осадка уменьшается в присутствии электролита, содержащего небольшое количество одноименного иона.
Пример 1. Вычислите растворимость PbCl2 в г/дм3 в воде, если  .
.
Решение. 1. Записываем процесс растворения малорастворимого электролита:
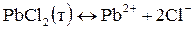 .
.
Соль диссоциирует на два иона  и один ион
и один ион  .
.
2. Молярные концентрации соли и ионов обозначаем через  :
:
 ;
;  ;
;  ; х = S.
; х = S.
3. Подставляем молярные концентрации ионов в уравнение произведения растворимости:
 ;
;
 .
.
4. Для вычисления растворимости в г/дм3 необходимо полученное значение растворимости в моль/дм3 умножить на массу одного моля вещества, т. е. на мольную массу ( ):
):
 г/моль.
г/моль.
Отсюда растворимость соли равна
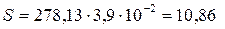 г/дм3.
г/дм3.
Ответ. Растворимость PbCl2 составляет 10,86 г/дм3.
Пример 2. Растворимость гидроксида магния Mg(OH)2 при 18 оС равна 1,7∙10–4 моль/дм3. Найдите произведение растворимости Мg(OH)2 при этой температуре.
Решение. При растворении каждого моля Mg(OH)2 в раствор переходит 1 моль ионов Mg2+ и вдвое больше ионов OH–:
 .
.
Следовательно, в насыщенном растворе Mg(OH)2
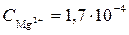 моль/дм3;
моль/дм3;  моль/дм3,
моль/дм3,
откуда

Ответ. Произведение растворимости гидроксида магния 1,96·10–11.
Пример 3. Вычислите растворимость Pb3(PO4)2 и выразите ее
в моль/дм3 и г/дм3, если  .
.
Решение. 1. Записываем процесс растворения малорастворимого электролита:
 .
.
Соль диссоциирует на три иона  и два иона
и два иона  .
.
2. Молярные концентрации соли и ионов обозначаем через  :
:
 ;
;  ;
;  ; х = S.
; х = S.
3. Подставляем молярные концентрации ионов в уравнение произведения растворимости:
 ;
;
 .
.
4. Для вычисления растворимости в г/дм3 необходимо полученное значение растворимости в моль/дм3 умножить на массу одного моля вещества, т. е. на мольную массу 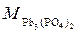 :
:
 г/моль.
г/моль.
Отсюда растворимость соли
 г/дм3.
г/дм3.
Ответ. Растворимость ортофосфата свинца 1,68·10–7 моль/дм3, или 1,37·10–4 г/дм3.
Пример 4. Выпадает ли осадок хромата серебра, если смешать 30 см3 раствора хромата калия 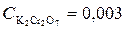 моль/дм3 с 20 см3 раствора нитрата серебра,
моль/дм3 с 20 см3 раствора нитрата серебра,  моль/дм3?
моль/дм3?
Решение. 1. Записываем уравнение химической реакции образования хромата серебра:
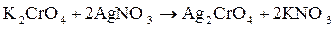 ;
;
 ;
;
 .
.
2. Находим в таблице 3 произведение растворимости хромата серебра  .
.
3. Чтобы ответить на вопрос, выпадет ли осадок, необходимо вычислить произведение концентраций ионов, образующих осадок, и сравнить его с величиной произведения растворимости.
Концентрации растворов уменьшились по сравнению с первоначальными значениями из-за того, что произошло увеличение общего объема после смешивания растворов:
 ,
,
 моль/дм3.
моль/дм3.
Аналогично вычисляем концентрацию ионов серебра:
 моль/дм3.
моль/дм3.
4. Рассчитываем произведение реальных концентраций ионов:
 .
.
5. Сравниваем величину произведения растворимости с произведением реальных концентраций ионов, получаем: произведение концентраций ионов превышает значение произведения растворимости,
1,22·10–11 > 1,1·10–12.
Ответ. Осадок хромата серебра выпадает.
Пример 5. Может ли образоваться осадок Mg(OH)2, если смешать равные объемы 0,5 М раствора MgCl2 и 0,1 М раствора NaOH?
Решение. При сливании двух равных объемов суммарный объем раствора увеличится вдвое, а концентрация уменьшится вдвое, то есть концентрация раствора MgCl2 будет равной 0,5/2 = 0,25 моль/дм3, а концентрация NaOH – равной 0,1/2 = 0,05 моль/дм3.
Mg2+ + 2ОH– → Mg(OH)2;

Найденное произведение концентраций ионов сравниваем с табличным значением произведения растворимости 
Так как произведение ионов превышает величину произведения растворимости 6,25·10–4 > 5,0·10–12, осадок выпадет.
Ответ. Осадок гидроксида магния выпадет.
Пример 6*. К смеси соединений KCl и K2CrO4 с концентрацией анионов 1∙10–3 моль/дм3 прибавляют по каплям раствор AgNO3 до образования осадка. Составьте уравнение протекающих реакций в молекулярном и ионном видах. Напишите уравнение диссоциации полученных малорастворимых соединений. Какое из этих соединений будет осаждаться в первую очередь? Рассчитайте массу воды, которая потребуется для растворения при комнатной температуре 1,0 г каждого из полученных соединений.
Решение. 1. При добавлении нитрата серебра (AgNO3) к смеси хлорида калия (KCl) и хромата калия (K2CrO4) протекают следующие реакции:
KCl + AgNO3 → AgCl↓ + KNO3
Cl– + Ag+ → AgCl↓;
K2CrO4 + 2AgNO3 → Ag2CrO4↓ + 2KNO3
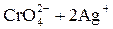 → Ag2CrO4↓
→ Ag2CrO4↓
Полученные малорастворимые соединения диссоциируют следующим образом:  ,
, 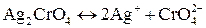 .
.
2. Запишем выражения для произведений растворимости полученных соединений и найдем их табличные значения:
 ;
;
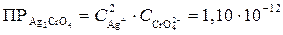 .
.
Решим выражения относительно 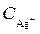 :
:
 моль/дм3;
моль/дм3;
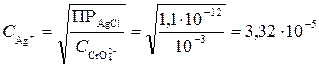 .
.
3. В первую очередь осаждается AgCl, т. к. в этом случае при меньшей концентрации ионов серебра (1,78∙10–7 моль/дм3) по сравнению с Ag2CrO4 (3,32∙10–5 моль/дм3) достигается величина произведения растворимости.
4. По величинам ПР солей находим концентрацию соответствующих солей в растворе.
а) Обозначим через x (моль/дм3) концентрацию ионов хлора (Cl–), тогда концентрация ионов серебра (Ag+) будет равняться также x (моль/дм3), и выражение для произведения растворимости AgCl можно записать в виде
 ,
,
откуда следует, что x = 1,3∙10–5 моль/дм3. Следовательно, массовая концентрация хлорида серебра (М AgCl = 143,5 г/моль) будет равна 143,5∙1,3∙10–5 = = 1,86∙10–3 г/дм3.
б) Обозначим через у (моль/дм3) концентрацию хромат-ионов  , тогда концентрация ионов серебра (Ag+) будет 2 у и выражение для произведения растворимости Ag2CrO4 можно записать в виде
, тогда концентрация ионов серебра (Ag+) будет 2 у и выражение для произведения растворимости Ag2CrO4 можно записать в виде
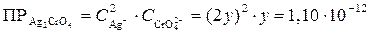 ,
,
откуда у = 0,65∙10–4 моль/дм3.
Следовательно, массовая концентрация хромата серебра (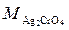 = 331,73 г/моль) равна:
= 331,73 г/моль) равна:
0,65∙10–4∙331,73 = 2,2∙10–2 г/дм3.
5. Если в каждом 1,0 дм3 воды может растворится только 1,86∙10–3 г хлорида серебра, то объем воды для растворения 1,0 г AgCl можно найти из пропорции:
1,86∙10–3 г – 1,0 дм3
1,0 г – x дм3
x = 537,6 дм3.
Аналогично найдем объем воды, в котором растворяется 1,0 г Ag2CrO4:
2,2∙10–2 г – 1,0 дм3
1,0 г – x дм3
x = 45,5 дм3.
Ответ. В первую очередь осаждается хлорид серебра (AgCl). Для растворения 1 г AgCl понадобится 537,6 г воды, а для растворения 1 г хромата серебра (Ag2CrO4) – 45,5 г.
Пример 7*. Гидроксиды каких ионов будут выпадать в осадок из ацетатно-буферного раствора с рН = 5 и концентрацией катионов 0,01 М:  = 5,5∙10–6;
= 5,5∙10–6;  = 9,2∙10–20;
= 9,2∙10–20;  = 6,3∙10–38.
= 6,3∙10–38.
Решение. 1. Выпадет ли осадок, зависит от того, превосходит ли концентрация соответствующих ионов (ПИ) произведение растворимости (ПР) указанных гидроксидов.
а) Ca2+ + 2OH– = Ca(OH)2,
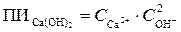 ;
;
б) Cu2+ + 2OH– = Cu(OH)2,
 ;
;
в) Fe3+ + 3OH– = Fe(OH)3,
 .
.
2. Определим концентрацию ионов водорода. Известно, что рН = 5. Следовательно, рОН = 14 – рН = 14 – 5 = 9, а  . Отсюда
. Отсюда 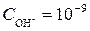 моль/дм3.
моль/дм3.
3. Подставим известные значения концентраций катионов металлов
и вычисленное значение концентрации гидроксид-ионов в выражение произведения ионов (ПИ) и вычислим их:
а) 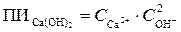 = 0,01∙(10–9)2 = 1∙10–20;
= 0,01∙(10–9)2 = 1∙10–20;
б)  = 0,01∙(10–9)2 = 1∙10–20;
= 0,01∙(10–9)2 = 1∙10–20;
в)  = 0,01∙(10–9)3 = 1∙10–29.
= 0,01∙(10–9)3 = 1∙10–29.
Ответ. Осадок гидроксидов Ca(OH)2 и Cu(OH)2 не выпадет, т. к.
ПИ < ПР; осадок Fe(OH)3 выпадет, для него ПИ > ПР.
Для решения задач данного раздела воспользуйтесь значениями величин ПР из таблицы 3.
***
161. Какая из двух солей больше растворима и во сколько раз: CaSO4 или BaSO4; BaCO3 или SrCO3; PbI2 или PbCl2?
162. Почему в фильтрате после промывания осадка CaCO3 появляется муть при добавлении раствора (NH4)2C2O4 и не происходит этого при добавлении раствора (NH4)2SO4?
163. В какой последовательности будут выпадать осадки, если к растворам, содержащим одинаковые концентрации ионов Ca2+, Ba2+, Sr2+ постепенно прибавлять раствор Na2SO4?
164. Останется ли прозрачным фильтрат из-под осадка PbCl2, если
к нему добавить раствор KI?
165. При какой концентрации (моль/дм3)  -ионов начнется образование осадка PbCrO4 из 0,1 М раствора Pb(NO3)2?
-ионов начнется образование осадка PbCrO4 из 0,1 М раствора Pb(NO3)2?
166. Смешали 100 см3 0,5 М раствора NaCl и 50 см3 0,5 М раствора AgNO3. Найдите массу образующегося осадка.
167. Какой объем 0,1 н раствора Ca(OH)2 потребуется для осаждения Ca2+-ионов из раствора Ca(HCO3)2 массой 489 г с массовой долей растворенного вещества равной 5 %?
168. Выпадет ли осадок BaSO4, если к 100 см3 0,2 М раствора H2SO4 добавить такой же объем 0,2 н раствора BaCl2?
169. В насыщенном растворе PbI2 концентрация I–-ионов равна 1,3∙10–3 моль/дм3. Определите концентрацию (моль/дм3) Pb2+-ионов в этом растворе.
170. Определите концентрацию (моль/дм3) каждого иона в насыщенном растворе Ag2CO3.
171. В 10 дм3 насыщенного раствора Mg3(PO4)2 содержится 3,00 г соли. Вычислите растворимость этой соли (моль/дм3).
172. При комнатной температуре растворимость PbI2 и Ca3(PO4)2 соответственно равна 6,5∙10–4 моль/дм3 и 1,7∙10–3 г/дм3. Определите произведение растворимости этих солей.
173. В 1 см3 насыщенного раствора CaSO4 содержится соль массой 0,408 мг. Найдите произведение растворимости этой соли.
174. Во сколько раз уменьшится растворимость AgCl в 0,01 М растворе NaCl по сравнению с его растворимостью в воде?
175. Во сколько раз уменьшится растворимость BaSO4 в 0,1 М раствора H2SO4 по сравнению с его растворимостью в чистой воде?
176. Осадок BaSO4 массой 0,5 г промыли 100 см3 воды. Вычислите потери BaSO4 (г), если считать промывные воды над осадком насыщенным раствором.
177. Определите потери в массовых долях (%) за счет растворимости осадка Mg(OH)2 массой 0,2 г при промывании его 250 см3 воды.
178. Определите массу CaCO3, которая перейдет в раствор при промывании осадка массой 0,3 г 250 см3 воды. Вычислите потери в массовых долях (%) за счет растворимости.
179*. Выпадет ли осадок Mg(OH)2, если к 25 см3 раствора, содержащего 0,6 М NH3 и 5,35 г/дм3 NH4Cl, прибавить 5 см3 0,03 М раствора MgCl2?  .
.
180*. К 60 см3 2 % раствора хлорида кальция с ρ = 1 г/см3 прибавили равный объем 10–2 м раствора фторида аммония. Выпавший осадок (ПРосадок = 4∙10–11) разделили на две части. К одной добавили насыщенный раствор хлорида алюминия, а к другой – 0,1 М раствора трилона Б. Подтвердите расчетами образование осадка.
181*. В 0,1 М растворе NaF содержится соль MgF2. Студент рассчитал концентрацию ионов магния в растворе как растворимость этой соли в воде (чему она равна?). Какую ошибку он допустил? Подтвердите ответ расчетами. 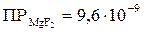 .
.
Дата публикования: 2015-10-09; Прочитано: 10942 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
