 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Осмотическое давление
|
|
Осмос – это односторонняя диффузия веществ из растворов через полупроницаемую перегородку, разделяющую раствор и чистый растворитель или два раствора различной концентрации.
В системе «растворитель – раствор» молекулы растворителя могут перемещаться через перегородку в обоих направлениях. Число молекул растворителя, переходящих в раствор в единицу времени, больше числа молекул, перемещающихся из раствора в растворитель. Это объясняется тем, что в растворе концентрация молекул растворителя ниже, чем в чистом растворителе, к тому же обратное движение молекул растворителя из раствора ограничено силами их сольватационного взаимодействия с частицами растворенного вещества.
Давление, которое надо приложить к раствору, чтобы скорости обоих процессов стали равными, называют осмотическим. На основании многочисленных опытных данных установлено, что к осмотическому давлению применимы все законы газового давления.
Осмотическое давление подчиняется газовым законам, то есть для его вычисления можно воспользоваться уравнением Менделеева – Клапейрона PV = nRT, несколько видоизменив его:
P осм. = СRT.
Заменив С на отношение m / M·V, получим
P осм. =  ,
,
где m – масса вещества, растворенного в 1 м3 раствора;
R – газовая постоянная, равная 8,314 Дж/моль·К;
T – абсолютная температура, К;
M – мольная масса растворенного вещества, г/моль;
V – объем раствора, м3.
Пример 1. Вычислите осмотическое давление раствора, содержащего в 1,5 дм3 135 г глюкозы С6H12O6 при 0 oC.
Решение. Мольная масса С6H12O6 составляет 180 г/моль. Тогда
P осм. =  Па.
Па.
Ответ. Осмотическое давление раствора глюкозы составляет 1135 кПа.
Пример 2. Определить мольную массу вещества, если в 5 дм3 его раствора содержится 25 г вещества. Осмотическое давление этого раствора равно 0,23∙105 Па при 20 oC.
Решение. Если в 5 дм3 раствора содержится 25 г вещества, то в 1 дм3 содержится 5 г.
Р осм. = 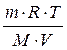 ,
,
отсюда
 ·г/моль.
·г/моль.
Ответ. Мольная масса вещества составляет 529,57 г/моль.
Пример 3. Чему равно при 0 оС осмотическое давление растворов неэлектролитов молярных концентраций: 0,100; 0,800; 0,025 моль/дм3?
Решение. Так как все растворы неэлектролитов молярной концентрации 1 моль/дм3 имеют одинаковое осмотическое давление, равное 8,314·273/10–3 = 22,7∙105 Па при 0 оС, то осмотическое давление растворов неэлектролитов заданных концентраций будет равно 0,1·22,7∙105 = 2,27∙105; 0,8∙22,7∙105 = 1,82∙106; 0,025·22,7∙105 = 2,67∙104 Па соответственно.
Ответ. Осмотические давления раствора неэлектролита для указанных концентраций равны 2,27∙105 Па; 1,82∙106 Па; 2,67∙104 Па соответственно.
Пример 4. Определите молекулярную массу неэлектролита, если его навеска массой 17,64 г была растворена в воде и объем раствора доведен до 1000 см3. Измеренное осмотическое давление раствора оказалось равным 2,38∙105 Па при 20 оС.
Решение. Подставляя экспериментальные данные в уравнение Вант-Гоффа Р осм. =  , получим:
, получим:
М = 17,64∙8,314∙293/2,38∙105∙10–3 = 180,6 г/моль.
Ответ. Молекулярная масса равна 180,6 а. е. м.
***
65. Чему равно осмотическое давление раствора неэлектролита при 27 оС, если в 500 см3 раствора содержится 0,6 моль вещества?
66. Осмотическое давление раствора мочевины ((NН2)2СО) при 0 оС равно 6,8∙105 Па. Найдите ее массу в 1 дм3 раствора.
67. Неэлектролит массой 11,5 г содержится в 250 см3 раствора. Осмотическое давление этого раствора при 17 оС равно 12,04∙105 Па. Определите мольную массу неэлектролита.
68. Чему равно осмотическое давление 0,5 М раствора глюкозы С6H12O6 при 25 oC?
69. Вычислите осмотическое давление раствора, содержащего 16 г сахарозы С12H22O11 в 350 г H2O при 293 К. Плотность раствора считать равной единице.
70. Сколько граммов глюкозы С6H12O6 должно находиться в 0,5 дм3 раствора, чтобы его осмотическое давление (при той же температуре) было таким же, как раствора, в 1 дм3 которого содержится 9,2 г глицерина С3H5(OH)3?
71. К 100 см3 0,5 М водного раствора сахарозы С12H22O11 добавлено 300 см3 воды. Чему равно осмотическое давление полученного раствора при 25 oC?
72. При 25 oC осмотическое давление раствора, содержащего 2,80 г высокомолекулярного соединения в 200 см3 раствора, равно 7,0 кПа. Найдите молекулярную массу растворенного вещества.
73. При 25 oC осмотическое давление некоторого водного раствора равно 1,24 МПа. Вычислите осмотическое давление раствора при 0 oC.
74. 200 см3 раствора содержат 1 г растворенного вещества и при 20 oC имеют осмотическое давление 0,43∙105 Па. Определите молярную массу растворенного вещества.
75. Раствор, в 100 см3 которого находится 2,30 г вещества, обладает при 298 К осмотическим давлением, равным 618,5 кПа. Определите молекулярную массу вещества.
76. Сколько молей неэлектролита должен содержать 1 дм3 раствора, чтобы его осмотическое давление при 25 oC было равно 2,47 кПа?
77. Вычислите осмотическое давление при 29 oC, если в 1 дм3 раствора содержит 90 г С6H12O6.
4.4.2. Понижение давления пара растворов
Давление пара растворителя над раствором нелетучих веществ всегда ниже давления пара над чистым растворителем при одной и той же температуре. Понижение давления пара растворителя над раствором вызвано уменьшением общей концентрации молекул растворителя в поверхностном слое раствора и процессом сольватации (гидратации), приводящим
к образованию сольватов (гидратов), из которых переход растворителя в пар затруднен.
Если обозначить давление пара растворителя через P 0, а давление раствора через P, то разность P 0 – P = Δ P покажет понижение давления пара. Отнеся эту разность к давлению пара растворителя, получим так называемое относительное понижение давления пара растворителя:
P 0 – P / P 0, или Δ P / P 0.
Согласно закону Рауля, относительное понижение давления пара растворителя равно отношению молей n растворенного вещества к общему числу молей N + n в растворе (растворителя и растворенного вещества):
P 0 – P / P 0 = n / N + n, или Δ P / P 0= n /(N + n).
Отношение n /(N + n) называют мольной долей растворенного вещества, поэтому закон Рауля может быть сформулирован так: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
Исходя из приведенных уравнений, можно определить
P = P 0 – [ P 0∙ n /(N + n)], или Δ P = P 0∙ n /(N + n).
Пример 1. Вычислите давление пара раствора, содержащего 34,2 г сахара С12H22O11 в 180 г H2O при 30 oС, если давление паров воды при этой температуре равно 0,42∙105 Па.
Решение. 1. Рассчитаем число молей растворенного вещества (n)
и число молей растворителя (N). Мольные массы воды и сахарозы равны соответственно:  г/моль;
г/моль; 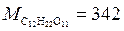 г/моль.Число молей растворенного вещества n = 34,2/342 = 0,1 моль, число молей растворителя
г/моль.Число молей растворенного вещества n = 34,2/342 = 0,1 моль, число молей растворителя
N = 180/18 = 10 моль.
2. Давление пара над растворителем найдем по закону Рауля:
 ;
;
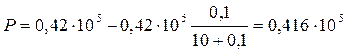 Па.
Па.
Ответ. Давление раствора пара сахарозы 41,6 кПа.
Пример 2. Определите мольную массу вещества, если над раствором 21 г вещества в 400 г ацетона давление пара равно 21854,40 Па. Давление пара ацетона (CH3)2CO при этой температуре равно 23939,35 Па.
Решение. 1. Определим число молей растворителя и растворенного вещества, которое определяется как отношение массы вещества к его мольной массе. Мольная масса ацетона равна  г/моль,
г/моль,
а N = 400/58 = 6,9 моль, число молей растворенного вещества n = 21/ M.
2. Относительное понижение давления пара растворителя над раствором равно:
∆ Р = (Р 0 – Р)/ Р 0 = n /(N + n);
P = P 0– [ P 0∙ n /(N + n)];
Δ P = (23939,35 – 21854,40)/23939,35 = (21/ М)/[6,9 + (21/ М)].
Решаем это уравнение относительно М и находим, что М = 32 г/моль.
Ответ. Мольная масса растворенного вещества 32 г/моль.
Пример 3. При 25 оС давление насыщенного пара воды составляет 3,166 кПа (23,75 мм рт. ст.). Определите при той же температуре давление насыщенного пара над 5 % водным раствором карбамида CO(NH2)2.
Решение. Для расчета по формуле Р 1 = N 1 P 0 нужно вычислить мольную долю растворителя N 1. В 100 г раствора содержится 5 г карбамида (мольная масса 60 г/моль) и 95 г воды (мольная масса 18 г/моль). Количество воды и карбамида соответственно равно:
n 1 = 95/18 = 5,278 моль; n 2 = 5/60 = 0,083 моль.
Находим мольную долю воды:
N 1 = n 1/(n 1 + n 2) = 5,278/(5,278 + 0,083) = 5,278/5,361 = 0,985.
Следовательно:
P 1 = 0,985∙3,166 = 3,119 кПа (или 23,31 мм рт. ст.).
Ответ. Давление насыщенного пара над 5 % водным раствором карбамида CO(NH2)2 составляет 3,119 кПа.
Пример 4. Навеска вещества массой 12,42 г растворена в 500 см3 воды. Давление пара полученного раствора при 20 оС равно 3732,7 Па. Давление пара воды при той же температуре равно 3742,0 Па. Рассчитайте мольную массу растворенного вещества.
Решение. Пользуясь законом Рауля ∆ Р = (Р 0 – Р)/ Р 0 = n /(N + n), или Δ P / P 0 = n 1/ n 2, и учитывая условия задачи, получим:
Δ P = 3742,0 – 3732,7 = 9,3 Па;
число молей воды n 2 = 500/18 = 27,78 моль, тогда число молей растворенного вещества n 1 будет равно:
n 1 = Δ P∙n 2/ P 0 = 9,3∙27,78/3742,0 = 0,069 моль.
Поскольку n 1 = m / M, то M = m / n 1 = 12,42/0,069 = 180 г/моль.
Ответ. Мольная масса растворенного вещества 180 г/моль.
***
78. Чему равно давление пара раствора, содержащего: а) мочевину массой 2,4 г в воде массой 90,0 г; б) глюкозу массой 27 г в 360 см3 воды? Давление паров воды равно 157,3 кПа.
79. Каким будет давление пара раствора при 65 оС, если он содержит сахарозу массой 13,68 г в воде массой 90,00 г, а давление водяного пара при той же температуре равно 25,0 кПа?
80. Давление водяного пара при 70 оС равно 31,173 кПа. Найдите понижение давления пара для раствора глюкозы с массовой долей 11,86 %.
81. Давление пара раствора, содержащего 0,05 моль вещества в воде массой 90 г, равно 52,47 кПа при 34 оС. Чему равно давление пара воды при этой температуре?
82. Анилин (C6H5NH2) массой 3,1 г растворен в эфире массой 40,2 г. Давление пара полученного раствора равно 813,9 кПа, а давление пара чистого эфира при той же температуре составляет 863,8 кПа. Рассчитайте молекулярную массу эфира.
83. Найдите при 65 oС давление пара над раствором 13,68 г сахарозы С12H22O11 в 90 г H2O, если давление насыщенного пара над водой при той же температуре равно 25,0 кПа (187,5 мм рт. ст.).
84. Чему равно давление насыщенного пара над 10 % раствором карбамида CO(NH2)2 при 100 oС?
85. При 315 К давление насыщенного пара над водой равно 8,2 кПа (61,5 мм рт. ст.). Насколько понизится давление пара при указанной температуре, если в 540 г воды растворить 36 г глюкозы С6H12O6?
86. При 293 К давление насыщенного пара над водой равно 2,34 кПа (17,53 мм рт. ст.). Сколько граммов глицерина C3H5(OH)3 надо растворить в 180 г воды, чтобы понизить давление пара на 133,3 Па (1 мм рт. ст.)?
87. Определите давление пара водного раствора глюкозы при 25 oС, если в 400 г воды содержится 100 г глюкозы С6H12O6. Давление пара воды при указанной температуре 3,17 кПа.
88. Определите давление пара раствора, содержащего 12,8 г нафталина C10H8 в 156 г бензола C6H6, при 20 oС. Давление пара бензола при 20 oС равно 9,954 кПа.
89. Давление пара раствора, содержащего 20 г растворенного вещества в 180 г воды, равно 3,64 кПа. Определите мольную массу растворенного вещества, если давление пара воды при этой температуре равно 3,78 кПа.
90. Вычислите давление пара раствора анилина C6H5NH2 в эфире (C2H5)2O при 20 oС, если в 370 г эфира содержится 9,3 г анилина. Давление пара чистого эфира при этой температуре 58,9 кПа.
91. Вычислите давление пара 30 % водного раствора карбамида CO(NH2)2 при 50 oС. Давление пара воды при этой температуре равно 12,33 кПа.
92. Давление пара ацетона (CH3)2CO при 20 oС равно 23,94 кПа. Определите давление пара раствора, содержащего 30,4 г камфары C10H16O в 580 г ацетона, при той же температуре.
Дата публикования: 2015-10-09; Прочитано: 6976 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
