 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Характеристики кипения и замерзания распространенных растворителей
|
|
| Растворитель | t кип., oС | Е кип., моль∙оС/кг | t кр., oС | K кр., моль∙оС/кг |
| Вода | 100,0 | 0,52 | 0,0 | 1,86 |
| Бензол | 80,2 | 2,53 | 5,4 | 5,12 |
| Уксусная кислота | 118,1 | 2,93 | 17,0 | 3,90 |
| Ацетон | 56,0 | 1,71 | – | – |
| Этиловый спирт | 78,3 | 1,22 | – | – |
| Диэтиловый эфир | 35,6 | 2,16 | –111,6 | – |
| Нафталин | – | – | 80,0 | 6,80 |
Эбуллиоскопические и криоскопические константы растворителей определяют исходя из экспериментальных данных. Зная эти константы растворителя и моляльную концентрацию раствора, можно рассчитать изменение температуры кипения (∆ t кип.) и изменение температуры кристаллизации (∆ t кр.) растворов по сравнению с данными температурами для чистых растворителей:
∆ t кип. = Е кип.∙ m ∙1000/(M∙m р-ля) или ∆ t кр. = K кр.∙ m ∙1000/(M∙m р-ля),
где m и M – масса и мольная масса растворенного вещества, г и г/моль;
m р-ля – масса растворителя, кг.
Пример 1. Определите температуру кипения раствора, содержащего 1,84 г нитробензола в 10 г бензола, эбуллиоскопическая константа бензола 2,53. Температура кипения чистого бензола 80,2 oС.
Решение. Повышение температуры кипения раствора определим по формуле ∆ t кип. = Е кип.∙ m ∙1000/(M∙m р-ля). Подставим значения и получим
∆ t кип. = 2,53∙1,85∙1000/(123∙10) = 3,8 oС. Температура кипения раствора равна:
t р-ра = t р-ля + ∆ t кип. = 80,2 + 3,8 = 84 oС.
Ответ. Раствор нитробензола в бензоле имеет температуру кипения 84 оС.
Пример 2. 4 г вещества растворены в 110 г этилового спирта. Раствор кипит при 78,62 oС. Определите мольную массу вещества. Эбуллиоскопическая константа спирта 1,22. Температура кипения спирта 78,3 oС.
Решение. Определим повышение температуры кипения раствора:
∆ t кип. = t р-ра – t р-ля = 78,62 – 78,3 = 0,32 oС.
Мольную массу вещества рассчитаем, пользуясь соотношением:
М = Е кип.∙ m ∙1000/(∆ t кип. ∙m р-ля);
М = 1,22∙4∙1000/(0,32∙110) = 138 г/моль.
Ответ. Молярная масса вещества 138 г/моль.
Пример 3. Рассчитайте, при какой температуре должен кристаллизоваться раствор, содержащий в 250 г воды 54 г глюкозы C6H12O6.
Решение.  = 180 г/моль. По формуле определим моляльность раствора:
= 180 г/моль. По формуле определим моляльность раствора:
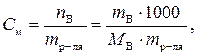
 .
.
По формуле: Δ t кр. = K кр.∙ С м находим: Δ t кр. = 1,86∙1,20 = 2,23 оС.
Ответ. Раствор будет кристаллизоваться при –2,23 °С, т. к. температура кристаллизации воды 0 оС.
Пример 4. Раствор, содержащий 8 г некоторого вещества в 100 г диэтилового эфира, кипит при 36,86 оС, тогда как чистый эфир кипит при 35,60 оС. Определите молекулярную массу растворенного вещества.
Решение. Из условия задачи находим:
Δ t кип. = 36,86 – 35,60 = 1,26 оС.
По уравнению Δ t кип. = Е кип.∙ С м определяем моляльность раствора:
С м = Δ t кип./ Е кип., С м = 1,26/2,02 = 0,624 моля на 1000 г эфира.
Мольную массу вещества найдем из соотношения


Ответ. Молекулярная масса растворенного вещества 128,2 а. е. м.
Пример 5. Раствор, содержащий 0,85 г хлорида цинка в 125 г воды, кристаллизуется при –0,23 оС. Определите кажущуюся степень диссоциации ZnCl2.
Решение. 1. Найдем моляльную концентрацию (С м) соли в растворе. Поскольку мольная масса ZnCl2 равна 136,3 г/моль, то
 .
.
2. Определим понижение температуры кристаллизации без учета диссоциации электролита (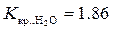 ):
):
Δ t кр. = K кр.∙ С м = 1,86∙0,05 = 0,093 оС.
3. Сравнивая найденное значение с экспериментально определенным понижением температуры кристаллизации, вычислим изотонический коэффициент i:
 .
.
3. Кажущуюся степень диссоциации ( ) соли ZnCl2 «Zn2+ + 2Cl–,
) соли ZnCl2 «Zn2+ + 2Cl–,
в растворе которой находится три заряженных частицы (n = 3), найдем
из соотношения

Ответ. Кажущаяся степень диссоциации хлорида цинка равна 0,735.
Пример 6. При растворении гидроксида натрия массой 12 г в воде массой 100 г температура кипения повысилась на 2,65 оС. Определите степень диссоциации (%) гидрокcида натрия.
Решение. Для растворов сильных электролитов в формулы расчета физических величин необходимо подставлять поправочный изотонический коэффициент (i):
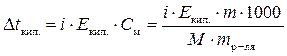 .
.
Отсюда  .
.
Тогда  , или 70 %, так как в растворе гидроксида натрия (NaOH «Na+ + OH–, n = 2) две заряженные частицы.
, или 70 %, так как в растворе гидроксида натрия (NaOH «Na+ + OH–, n = 2) две заряженные частицы.
Ответ. Степень диссоциации гидроксида натрия 70 %.
***
93. Определите мольную массу растворенного вещества, 4 г которого растворено в 100 г воды. Полученный раствор замерзает при –0,93 oС.
94. Температура кипения водного раствора сахарозы С12H22O11 равна 101,4 oС. Вычислите моляльную концентрацию. При какой температуре замерзает этот раствор?
95. При какой температуре кристаллизуется водный раствор, содержащий 3∙1023 молекул неэлектролита в 250 г H2O?
96. При растворении 5,0 г вещества в 200 г воды получается не проводящий тока раствор, кристаллизующийся при –1,45 oС. Определите мольную массу растворенного вещества.
97. При растворении 13,0 г неэлектролита в 400 г диэтилового эфира (C2H5)2O температура кипения повысилась на 0,453 К. Определите мольную массу растворенного вещества.
98. При какой температуре будет кристаллизоваться 40 % (по массе) раствор этилового спирта C2H5OH?
99. Сколько граммов сахарозы С12H22O11 надо растворить в 100 г воды, чтобы: а) понизить температуру кристаллизации на 1 оС; б) повысить температуру кипения на 1 оС?
100. На сколько градусов повысится температура кипения воды, если в 100 г воды растворить 45 г глюкозы С6H12O6?
101. При какой температуре будет кипеть 50 % (по массе) водный раствор сахарозы С12H22O11?
102. Раствор, содержащий неэлектролит массой 0,512 г в бензоле массой 100,000 г, кристаллизуется при 5,296 оС. Температура кристаллизации бензола равна 5,500 оС. Вычислите мольную массу растворенного вещества.
103. Вычислите массовую долю (%) водного раствора сахара (С12Н22О11), зная, что температура кристаллизации раствора равна –0,93 оС.
104. Вычислите температуру кристаллизации водного раствора мочевины ((NH2)2CO), содержащего мочевину массой 5 г в воде массой 150 г.
105. Раствор, содержащий камфору (C10H16O) массой 3,04 г в бензоле массой 100,00 г, кипит при 80,714 оС. Температура кипения бензола 80,2 оС. Вычислите эбуллиоскопическую константу бензола.
106. Вычислите массовую долю (%) глицерина (С3Н8О3) в водном растворе, зная, что этот раствор кипит при 100,39 оС.
107. Вычислите мольную массу неэлектролита, зная, что раствор, содержащий этот неэлектролит массой 2,25 г в воде массой 250,0 г, кристаллизуется при температуре –0,279 оС.
108. Сколько мочевины ((NH2)2CO) следует растворить в воде массой 250 г, чтобы температура кипения повысилась на 0,26 оС?
109. При растворении некоторого неэлектролита массой 2,3 г в воде массой 125,0 г температура кристаллизации понижается на 0,372 оС. Вычислите мольную массу неэлектролита.
110. Какую массу мочевины ((NH2)2CO) следует растворить в воде массой 75 г, чтобы температура кристаллизации понизилась на 0,465 оС?
111. Вычислите массовую долю (%) глюкозы (C6H12O6) в водном растворе, зная, что это раствор кипит при 100,26 °С.
112. Какую массу фенола (C6H5OH) следует растворить в бензоле массой 125 г, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7 оС?
113. Вычислите температуру кипения раствора нафталина (С10Н8)
в бензоле с массовой долей 5 %. Температура кипения бензола 80,2 оС.
114. Раствор, содержащий некоторый неэлектролит массой 25,65 г
в воде массой 300,00 г, кристаллизуется при температуре –0,465 оС. Вычислите мольную массу неэлектролита.
115. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий антрацен (С14H10) массой 4,25 г в уксусной кислоте массой 100,00 г, кристаллизуется при 15,718 оС. Температура кристаллизации уксусной кислоты 16,650 оС.
116. При растворении серы массой 4,86 г в бензоле массой 60,00 г температура его кипения повысилась на 0,81 оС. Из скольких атомов состоит молекула серы в этом растворе?
117. Температура кристаллизации раствора, содержащего некоторый неэлектролит массой 66,3 г в воде массой 500,0 г, равна –0,558 оС. Вычислите мольную массу неэлектролита.
118. Какую массу анилина (C6H5NH2) следует растворить в этиловом эфире массой 50 г, чтобы температура кипения этилового эфира была ниже температуры кипения раствора на 0,53 оС?
119. Вычислите температуру кристаллизации раствора этилового спирта (С2Н5ОН) с массовой долей 2 %.
120*. Определите формулу вещества, в котором массовая доля углерода составляет 40,00 %, водорода – 6,66 %, серы – 53,34 %. Раствор, содержащий это вещество массой 0,3 г в бензоле массой 27,0 г, имеет температуру замерзания на 0,308 оС ниже температуры замерзания бензола.
121. Раствор, содержащий пероксид водорода массой 1,477 г в воде массой 100,00 г, замерзает при температуре –0,805 оС. Вычислите молекулярную массу пероксида водорода.
122. Температура кипения раствора, содержащего салициловую кислоту (С7Н6О3) массой 5,7 г в спирте массой 125,0 г, равна 78,4 оС. Температура кипения чистого спирта равна 78,0 оС. Вычислите эбуллиоскопическую константу спирта.
123. В каких объемных отношениях надо взять воду и этиленгликоль (ρ = 1,116 г/см3), чтобы приготовленный из них антифриз замерзал при –20 оС?
124. Определите изотонический коэффициент раствора, содержащего KОН массой 2,1 г в воде массой 250,0 г и замерзающего при температуре –0,519 оС.
125. Раствор, содержащий карбонат натрия массой 0,53 г в воде массой 200,00 г, кристаллизуется при –0,13 оС. Вычислите кажущуюся степень диссоциации этой соли.
126. Определите степень диссоциации (%) раствора, содержащего хлорид аммония массой 1,07 г в 200 см3 воды, если температура кипения этого раствора равна 100,09 оС.
127. Какое значение имеет степень диссоциации (%) раствора хлорида кобальта, моляльность которого равна 0,12 моль/кг, если он замерзает при –0,62 оС?
128. Определите моляльность раствора бинарного электролита, если его водный раствор замерзает при –0,31 оС, а степень диссоциации равна 66,5 %.
129. Кажущиеся степени диссоциации 0,1 М растворов CaCl2 и AlCl3 приблизительно одинаковы. Какой из растворов будет замерзать при более низкой и кипеть при более высокой температуре?
130. Раствор KCl, моляльность которого равна 1 моль/кг, замерзает при –3,36 оС. Определите изотонический коэффициент и степень диссоциации (%).
131. Чему равен изотонический коэффициент для растворов бинарных электролитов при следующих значениях степени диссоциации: 1,0 %; 0,5 %; 75,0 %?
132. Чему равен изотонический коэффициент 0,1 н раствора сульфата цинка, если экспериментально найденная степень диссоциации равна 40 %?
133. Определите концентрацию ионов Na+ и 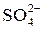 в 250 см3 раствора, содержащего сульфат натрия массой 3,55 г, считая диссоциацию соли полной.
в 250 см3 раствора, содержащего сульфат натрия массой 3,55 г, считая диссоциацию соли полной.
134. Чему равна концентрация ионов Fe3+ и 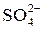 в 400 см3 раствора, содержащего сульфат железа (III) массой 1,6 г, если считать диссоциацию соли полной?
в 400 см3 раствора, содержащего сульфат железа (III) массой 1,6 г, если считать диссоциацию соли полной?
Дата публикования: 2015-10-09; Прочитано: 11282 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
