 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Решение. Пусть масса Fe3O4 в смеси составит x г, тогда масса оксида железа (II) будет равна (14,8 – x) г
|
|
С серной кислотой смещанный оксид (FeO·Fe2O3, который в общем виде записывается как Fe3O4) и оксид железа (II) реагируют следующим образом:
Fe3O4 + 4H2SO4 = FeSO4 + Fe2(SO4)3 + 4H2O; (1)
FeO+ H2SO4 = FeSO4+ H2O. (2)
 = 72 г/моль;
= 72 г/моль; 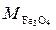 = 232 г/моль;
= 232 г/моль;  = 98 г/моль.
= 98 г/моль.
Пусть масса Fe3O4 в смеси составит x г, тогда масса оксида железа (II) будет равна (14,8 – x) г. Из уравнения реакции (1) следует, что масса H2SO4 составит 4∙98∙ x /232 = 1,69∙ x г, а из уравнения реакции (2) масса H2SO4 составит 98∙(14,8 – х)/72 = (20,1 – 61,36∙ х) г.
Из условия задачи масса H2SO4 (w % = 100 %) будет равна 93,5∙1,15∙0,21 = 22,6 г, или 22,6/98 = 0,23 моль. Тогда 22,6 = 1,69∙ х + 20,1 – – 1,36∙ х. откуда х = 7,6 г Fe3O4, масса FeO составит 14,8 – 7,6 = 7,2 г.
Следовательно: w % = 7,6∙100/14,8 = 51,35 % Fe3O4;
w % = 100 – 51,35 = 48,65 % FeO.
***
1. Из раствора соли (w % = 16 %) массой 640 г выпарили воду массой 160 г и при этом выпал осадок массой 8 г. Вычислите содержание соли
в растворе в массовых долях.
2. Какую массу раствора серной кислоты с массовой долей 50 % следует добавить к 150 см3 воды для получения раствора серной кислоты
с массовой долей 20 %?
3. Рассчитайте массу раствора KOH с массовой долей 7,9 %, в котором нужно растворить K2O массой 47 г для получения раствора KOH с массовой долей 21,0 %.
4. Рассчитайте объемы раствора серной кислоты с массовой долей 93,5 % (ρ = 1,83 г/см3) и воды, необходимые для приготовления 100 см3 раствора серной кислоты с массовой долей 15 % (ρ = 1,10 г/см3).
5. Какие объемы воды и раствора серной кислоты с массовой долей 80 % (ρ = 1,74 г/см3) необходимо взять для приготовления 500 см3 раствора серной кислоты с массовой долей 10 % (ρ = 1,07 г/см3).
6. Определите молярную концентрацию раствора KOH, в котором массовая доля KOH составляет 8 % (ρ = 1,064 г/см3).
7. Определите массовую долю (%) серной кислоты в 2 н растворе
(ρ = 1,065 г/см3).
8. Определите массовую долю (w %) растворенного вещества в растворах: а) 6М HCl (ρ = 1,100 г/см3); б) 10 н H2SO4 (ρ = 1,289 г/см3); в) 15 н H3PO4 (ρ = 1,289 г/см3).
9. Определите массы растворов соляной кислоты с массовыми долями 10 % и 30 %, при смешении которых образуется раствор соляной кислоты массой 600 г с массовой долей 15 %.
10. Смешали растворы хлорида натрия массами 300 г и 500 г с процентным содержанием 20 % и 40 % соответственно. Найдите массовую долю полученного раствора хлорида натрия.
11. Определите массовую долю раствора серной кислоты, полученного смешением растворов серной кислоты массами 247 г и 147 г с массовыми долями 62 % и 18 % соответственно.
12. Рассчитайте массу раствора соли с массовой долей 7 %, необходимую для растворения еще 20 г этой соли, чтобы получить раствор с массовой долей 12 %.
13. Определите массы растворов NaOH с массовыми долями 12 % и 40 %, необходимые для получения 100 см3 раствора NaOH с массовой долей 25 % (ρ = 1,275 г/см3).
14. В 1 дм3 спирта (ρ = 0,8 г/см3) растворили сероводород объемом 10 дм3 (н. у.). Определите массовую долю (w %) сероводорода в полученном растворе.
15. Какой объем сернистого ангидрида при 290 К и давлении 98,5 кПа следует растворить в 0,5 дм3 воды для получения раствора с массовой долей SO2 1,0 %?
16. Сколько и какого вещества останется в избытке, если к 75 см3 0,3 н раствора серной кислоты прибавить 125 см3 0,2 н раствора KOH?
17. Имеется 3,0 н раствор кислоты и 1,5 н раствор щелочи. Какой объем кислоты следует добавить к 2 дм3 щелочи до полной ее нейтрализации?
18. Раствор содержит бромид и хлорид натрия одинаковой концентрации (w %). Определите массовые доли (%) этих солей, если для их полного осаждения из раствора массой 1 кг потребовался 1 дм3 раствора нитрата серебра с массовой долей 8 % (ρ = 1,07 г/см3).
19. К раствору хлорида кальция объемом 100 см3 (w % = 10,6 %,
ρ = 1,05 г/см3) добавили раствор карбоната натрия объемом 30 см3
(w % = 38,55 %, ρ = 1,10 г/см3). Определите массовые доли соединений, содержащихся в растворе после отделения осадка.
20. Определите массу глауберовой соли (Na2SO4∙10H2O), необходимую для ее растворения в воде массой 500 г для получения раствора с массовой долей 5 %, считая на безводную соль.
21. Определите массовую долю (w %) FeSO4 в растворе, полученном при растворении FeSO4∙7H2O массой 208,5 г в воде массой 129,5 г.
22. Какую массу Na2CO3∙10H2O нужно растворить в воде массой 350 г, чтобы получить раствор с массовой долей карбоната натрия 0,1?
23. Какая масса кристаллогидрата CaCl2∙6H2O потребуется для приготовления раствора массой 1750 г, если его моляльность равна 0,2 моль/кг Н2О?
24*. Для полного осаждения меди в виде CuS из 291 см3 раствора CuSO4 c массовой долей 10 % был использован газ, полученный при взаимодействии FeS массой 17,6 г с избытком раствора HCl. Рассчитайте относительную плотность исходного раствора CuSO4.
25*. На нейтрализацию 500 см3 раствора смеси H2SO4 + NaHSO4 затрачено 142,85 см3 раствора NaOH c массовой долей 4 % (ρ = 1,05 г/см3). После упаривания этого раствора получена глауберова соль (Na2SO4∙10H2O) массой 32,2 г. Сколько молей H2SO4 и NaHSO4 содержалось в исходном растворе?
26. В растворе серной кислоты массой 446 г с массовой долей 7,8 % растворили SO3 массой 250 г. Найдите массовую долю H2SO4 в полученном растворе.
27. В производстве аммиачной селитры применяется раствор с массовой долей азотной кислоты 60 %. Выразите концентрацию этого раствора
в моль/дм3 (ρ = 1,373 г/см3).
28. При растворении серной кислоты массой 66,8 г в воде массой 133,2 г получили раствор (ρ = 1,25 г/см3). Определите: а) молярную концентрацию; б) эквивалентную концентрацию; в) массовую долю (w %) серной кислоты в полученном растворе.
29. Титр раствора H2SO4 равен 0,0049 г/см3. Рассчитайте эквивалентную концентрацию раствора H2SO4.
30. На нейтрализацию 60 см3 0,24 н раствора серной кислоты израсходовано 180 см3 раствора KOH. Рассчитайте эквивалентную концентрацию раствора KOH.
31. Чему равна эквивалентная концентрация раствора NaOH с массовой долей 30 % (ρ = 1,328 г/см3)? К 1 дм3 этого раствора прибавили 5 дм3 воды. Вычислите (w %) NaOH в полученном растворе.
32. К 3 дм3 раствора азотной кислоты с массовой долей 10 %
(ρ = 1,054 г/см3) прибавили 5 дм3 раствора той же кислоты с массовой долей 2 % (ρ = 1,009 г/см3). Вычислите массовую долю (w %), молярную, эквивалентную концентрации и титр полученного раствора.
33. Вычислите эквивалентную и моляльную концентрации раствора азотной кислоты с массовой долей 20,8 % (ρ = 1,12 г/см3). Сколько граммов азотной кислоты содержится в 4 дм3 этого раствора?
34. Для получения суперфосфата применяется раствор, в котором массовая доля серной кислоты составляет 65 %. Сколько воды и раствора серной кислоты с массовой долей 92 % потребуется для приготовления 1 тонны такого раствора?
35. Какую массу Na2CO3∙10H2O cледует взять для приготовления 1,2 дм3 0,2 н раствора карбоната натрия?
36. Рассчитайте массу медного купороса, необходимую для приготовления 2 дм3 0,25 М раствора CuSO4.
37. Определите массу карбоната натрия, содержащуюся в 250 см3 0,2 н раствора.
38. Растворы одного и того же вещества молярной концентрации 1,0; 2,0 и 0,2 моль/дм3 смешаны в объемных отношениях 1: 2: 7. Определите молярную концентрацию полученного раствора.
39. Определите эквивалентную концентрацию раствора, полученного при смешении 2,0 дм3 0,5 н и 0,5 дм3 2,0 н растворов.
40. Какой объем 2,0 н раствора следует взять для получения 500 см3 0,5 н раствора?
41. Как из 2,00 М раствора соды приготовить 0,25 н раствор?
42. Какой объем раствора KОН с массовой долей 12 % (ρ = 1,11 г/cм3) надо взять для приготовления 250 cм3 2М раствора?
43. Какой объем раствора серной кислоты с массовой долей 90 %
(ρ = 1,81 г/см3) надо взять, чтобы получить 250 см3 2М раствора?
Дата публикования: 2015-10-09; Прочитано: 3102 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
