 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Решение. Пусть масса Na2O – х г, масса раствора составит (169 + х) г
|
|
Na2O + H2O = 2NaOH.
М (Na2O) = 62 г/моль; М (NaOH) = 40 г/моль.
Пусть масса Na2O – х г, масса раствора составит (169 + х) г. Тогда
в соответствии с реакцией из х г Na2O образуется 2∙40∙ х /62 = 1,29∙ х г NaOH и, следовательно, масса NaOH станет равной (40 + 1,29∙ х) г.
Подставим введенные обозначения в формулу

и получим
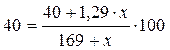 , х = 31 г.
, х = 31 г.
Ответ. К раствору необходимо добавить 31 г Na2O.
Пример 8. Какой объем NH3 (н. у.) необходимо растворить в воде массой 700 г, чтобы получить раствор аммиака с массовой долей 15 %?
Решение. Искомую величину, т. е. объем аммиака, обозначим через x дм3. Тогда масса аммиака составит 17∙ х /22,4 = 0,76∙ х г (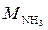 = 17 г/моль). Масса раствора составит по условию задачи (700 + 0,76 x) г.
= 17 г/моль). Масса раствора составит по условию задачи (700 + 0,76 x) г.
Введенные величины подставим в формулу

и решим относительно х:
 , х = 163 дм3.
, х = 163 дм3.
Ответ. Необходимо растворить 163 дм3 NH3.
Пример 9. Определите массы SO3 и раствора H2SO4 c массовой долей 49,0 %, необходимые для приготовления раствора серной кислоты массой 450 г и массовой долей 83,3 %.
Дата публикования: 2015-10-09; Прочитано: 586 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
