 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Вычисления количественного состава растворов
|
|
Для определения состава растворов используют различные способы выражения их концентрации.
Молярная концентрация вещества В (символ – 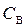 , единица измерения – моль/дм3, или М) равна количеству вещества В, содержащегося
, единица измерения – моль/дм3, или М) равна количеству вещества В, содержащегося
в одном литре (дм3) раствора. Рассчитывается по формуле
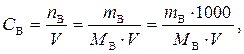
где n B – количество растворенного вещества В, моль;
m B – масса растворенного вещества В, г;
M B – мольная концентрация вещества В, г/моль;
V – объем раствора, дм3 (см3).
Молярная концентрация эквивалента (эквивалентная концентрация) вещества В (символ – С Э, В, единица измерения – моль/дм3, или н) равна количеству эквивалентов вещества В, содержащегося в одном литре (дм3) раствора. Рассчитывается СЭ, В по формуле
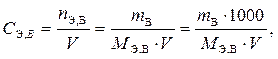
где n Э, В – количество эквивалентов вещества В, моль;
m В – масса растворенного вещества В, г;
V – объем раствора, дм3 (см3);
M Э, В – мольная масса эквивалента вещества В (эквивалентная масса), г/моль.
Как определять эквивалентные массы веществ (M Э), смотри раздел 1.2.
Моляльная концентрация вещества В (символ – С м, В, единица измерения – моль/кг) равна количеству вещества В в одном килограмме растворителя. Вычисляют С м, В как отношение количества вещества В к массе растворителя
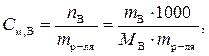
где n B – количество вещества В, моль;
m B – масса вещества В, г;
m р-ля – масса растворителя, кг (г);
M B – мольная масса вещества В, г/моль.
Массовая доля вещества В (символ – w B, безразмерная величина) равна отношению массы компонента В исследуемого образца к массе всего образца или массы вещества В к массе раствора. Рассчитывают массовую долю вещества В в растворе по формуле
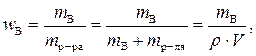
где m B – масса растворенного вещества В, г;
m р-ра – масса раствора, г;
m р-ля – масса растворителя, г;
ρ – плотность раствора, г/см3;
V – объем раствора, см3.
Когда необходимо рассчитать процентное содержание вещества, массовую долю вещества умножают на 100, например
 .
.
Массовая концентрация вещества В (символ – γ В, единица измерения – г/дм3) равна массе растворенного вещества В в одном литре раствора. Рассчитывается по формуле
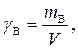
где m B – масса растворенного вещества В, г;
V – объем раствора, дм3.
Титр вещества В (символ – Т В, единица измерения – г/см3) равен массе растворенного вещества В в 1 см3 раствора и рассчитывается по формуле
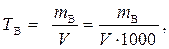
где m B – масса растворенного вещества В, г;
V – объем раствора, см3 (дм3).
Пример 1. Рассчитать молярную концентрацию и молярную концентрацию эквивалента, титр для раствора с массовой долей (%) уксусной кислоты в нем 1,5 %, плотность раствора 1,020 г/см3.
Решение. 1. Зная массовую долю уксусной кислоты в растворе и плотность раствора, можно рассчитать массу CH3COOH в этом растворе, выразив m из первоначальной формулы
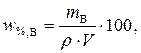
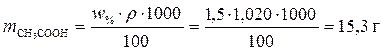 .
.
2. Молярная концентрация рассчитывается по формуле
 ,
,
а молярная концентрация эквивалента рассчитывается по формуле
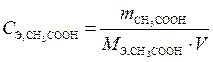 .
.
Молярная концентрация CH3COOH и молярная концентрация эквивалента CH3COOH – величины равные, т. к. CH3COOH – кислота одноосновная, фактор эквивалентности для которой равен f Э = 1.
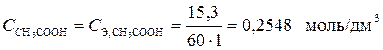 ,
,
т. к. 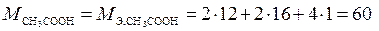 г/моль.
г/моль.
3. Титр раствора CH3COOH рассчитаем по формуле
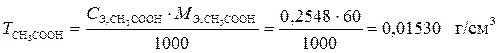 .
.
Пример 2. Какую навеску необходимо взять для приготовления
1,5 дм3 раствора KOH с молярной концентрацией эквивалента 0,15 н?
Решение. Молярная концентрация эквивалента определяется по формуле
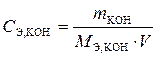 ,
,
где m KOH – масса KOH, г;
M Э,KOH – мольная масса эквивалента KOH, г/моль;
V – объем раствора, дм3.
Навеска – это точно измеренная масса, ее и надо найти из формулы выше. Выразим m и подставим численные значения, зная, что M Э,KOH =
= M KOH = 39 + 16 + 1 = 56 г/моль, находим массу KOH, необходимую для приготовления данного раствора,
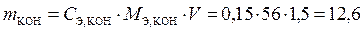 г.
г.
Ответ. Для приготовления раствора объемом 1,5 дм3 и концентрацией 0,15 н необходимо взять 12,6 г гидроксида калия.
Пример 3. Какую навеску NaCl необходимо взять для приготовления 2,0 дм3 раствора с массовой долей 20 % (ρ = 1,11 г/см3)?
Решение. Массовая доля вещества определяется по формуле
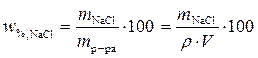 .
.
Выражаем и находим массу NaCl:
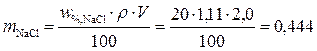 г.
г.
Ответ. Необходимо взять навеску хлорида натрия массой 0,444 г.
Пример 4. Какой объем (см3) раствора H2SO4 с концентрацией 98 % (ρ = 1,86 г/см3) нужно взять для приготовления раствора объемом 1,0 дм3
с молярной концентрацией эквивалента 0,2 н?
Решение. 1. Найдем мольную массу эквивалента H2SO4, фактор эквивалентности для которой равен f Э = 2, т. к. в составе кислоты два атома водорода.
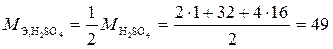 г/моль.
г/моль.
2. Определим массу H2SO4, которая содержится в 1,0 дм3 раствора
с молярной концентрацией эквивалента 0,2 н,
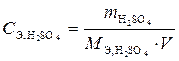 ;
;
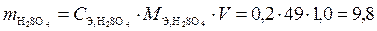 г.
г.
3. Зная массу H2SO4, которая должна содержаться в приготовленном растворе, найдем объем серной кислоты с массовой долей 98 %
(ρ = 1,86 г/см3):
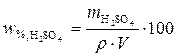 ;
;
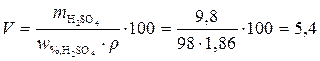 см3.
см3.
Ответ. Необходимо взять 98 % раствор серной кислоты объемом 5,4 см3.
Пример 5. Определить процентную концентрацию раствора, полученного путем смешивания двух растворов одного и того же растворенного вещества. Смешали 20 см3 30 % раствора KOH (r = 1,23 г/см3)и 50 см3 12 % раствора (r = 1,15 г/дм3).
Решение. 1. Процентное содержание полученного раствора определим по формуле
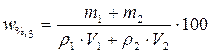 ,
,
для этого необходимо рассчитать массы растворенных веществ в каждом из имеющихся растворов (m 1 и m 2).
2. Массы растворенных веществ определим по формуле
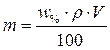 .
.
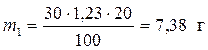 и
и  .
.
3. Полученные значения подставим в выражение
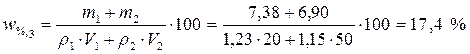 .
.
Ответ. Процентная концентрация полученного раствора составляет 17,4 %.
Пример 6. Из раствора сахара с массовой долей 15 % выпарили воду массой 60 г, в результате образовался раствор сахара с массовой долей 18 %. Определите массу исходного раствора сахара.
Решение. Пусть масса исходного раствора – х г, тогда из условия задачи следует, что масса сахара в исходном растворе составит 0,15∙ х г. После выпаривания масса раствора составит (х – 60) г, а масса сахара в этом растворе – 0,18(х – 60) г. Отсюда: 0,15∙ х = 0,18(х – 60); х = 360 г.
Ответ. Масса исходного раствора сахара составляла 360 г.
Пример 7. Определите массу Na2O, которую нужно добавить к раствору массой 169 г, содержащему NaOH массой 40 г, чтобы массовая доля NaOH в растворе стала равной 40 %.
Дата публикования: 2015-10-09; Прочитано: 899 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
