 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Эквивалент. Закон эквивалентов
|
|
Эквивалентом называется такое количество вещества (моль), которое без остатка соединяется с одним атомом водорода или замещает то же его количество в химических реакциях.
Масса одного эквивалента вещества – это его мольная масса эквивалента (эквивалентная масса) M Э [г/моль].
Эквивалент вещества, а следовательно, и эквивалентная масса зависят от валентности элементов.
Валентность – способность атома образовывать определенное число ковалентных связей.
За единицу валентности принимают валентность атома водорода 1.

А поскольку все элементы образуют соединения с кислородом и учитывая, что атом кислорода всегда присоединяет два атома одновалентного элемента, нетрудно определить валентности.
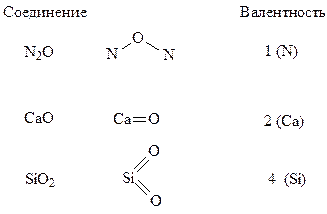
Пример 1. Определите эквивалент и эквивалентные массы брома, кислорода и азота в соединениях HBr, H2O, NH3.
Решение. В указанных соединениях с 1 молем атомов водорода соединяется 1 моль атомов брома, 1/2 моль атомов кислорода и 1/3 моль атомов азота. Следовательно, согласно определению, эквиваленты брома, кислорода и азота равны соответственно 1 молю, 1/2 моля и 1/3 моля.
Исходя из мольных масс атомов этих элементов, найдем, что эквивалентная масса брома равна 79,9 г/моль, кислорода – 16∙1/2 = 8 г/моль, азота – 14∙1/3 = 4,67 г/моль.
Эквивалентную массу можно вычислить по составу соединения, если известны мольные массы (М).
Эквивалентная масса элемента определяется из соотношения:

где А эл. – атомная масса элемента, г/моль.
При определении эквивалентной массы оксида (ЭхОу) удобно пользоваться формулами
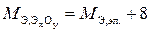 или
или 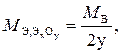
где М Э,эл. – эквивалентная масса элемента, г/моль;
8 – эквивалентная масса кислорода в оксидах, величина постоянная, найденная из соотношения 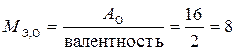 г/моль;
г/моль;
2 – валентность кислорода в оксидах;
у – число атомов кислорода в составе оксида.
Эквивалентная масса соединений более сложного состава (M Э,В) определяется из соотношения
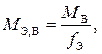
где M B – мольная масса вещества В, г/моль;
f Э – эквивалентное число (фактор эквивалентности).
Эквивалентные числа определяются следующим образом:
f Э (кислоты) – числом ионов H + (например, для H2SO4 f Э = 2);
f Э (основания) – числом ионов OH – (например, для Al(OH)3 f Э = 3);
f Э (соли) – суммарным зарядом всех катионов данной соли, который определяется как произведение заряда катиона или аниона (z) на их количество (n) (например, для Al(OH)2Cl f Э = 1, для Al2(SO4)3 f Э = 6 и т. д.).
Пример 2. Определите эквивалентные массы следующих веществ: Al, Fe2O3, Ca(OH)2, H2SO4, CaCO3.
Решение. 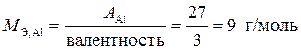 ;
;
 ;
;
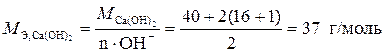 ;
;
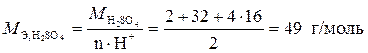 ;
;
 .
.
Эквивалентное число и мольная масса эквивалента (эквивалентная масса) – величины непостоянные и зависят от стехиометрии реакции, в которой они принимают участие.
f Э определяется:
– в кислотно-основных реакциях – числом замещенных ионов водорода или гидроксильных групп;
– в окислительно-восстановительных реакциях – числом принятых или отданных электронов;
– в реакциях комплексообразования – числом зарядов катионов металла, которые принимают участие в образовании молекулы комплексного иона;
– в реакциях осаждения – числом зарядов катионов металла, участвующих в образовании малорастворимого соединения.
Реакции нейтрализации. Взаимодействие гидроксида натрия (NaOH)
с фосфорной кислотой (H3PO4) может протекать с образованием кислых
(1, 2) и средней (3) солей:
1) 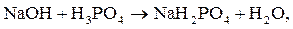
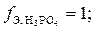
2) 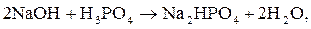
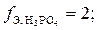
3) 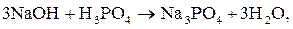
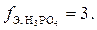
В первом случае только один ион водорода фосфорной кислоты замещается на катион металла, отсюда и эквивалентное число равно единице. Во втором случае два иона водорода фосфорной кислоты замещаются на ионы металла, следовательно, 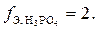 В третьем случае три иона водорода кислоты замещаются на катионы натрия,
В третьем случае три иона водорода кислоты замещаются на катионы натрия, 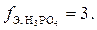
Окислительно-восстановительные реакции. Рассмотрим на примере восстановления  (ионов
(ионов 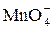 ) в зависимости от реакции среды.
) в зависимости от реакции среды.
Полуреакция
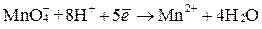
выражает восстановление ионов 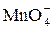 в ионы
в ионы 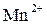 в кислой среде (рН < 7), в результате чего происходит принятие пяти электронов, следовательно,
в кислой среде (рН < 7), в результате чего происходит принятие пяти электронов, следовательно, 
В щелочной среде (рН > 7) ионы 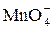 восстанавливаются до молекулы оксида марганца (IV)
восстанавливаются до молекулы оксида марганца (IV) 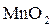 , что выражается полуреакцией
, что выражается полуреакцией
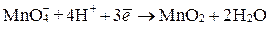 ,
,
в результате которой происходит принятие трех электронов. Следовательно, 
В нейтральной среде ионы 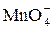 восстанавливаются до ионов
восстанавливаются до ионов  , что связано с принятием только одного электрона:
, что связано с принятием только одного электрона:
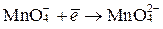 , а
, а 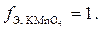
Так, для  , в зависимости от реакции среды, f Э может принимать значения 1, 3 или 5.
, в зависимости от реакции среды, f Э может принимать значения 1, 3 или 5.
Реакции комплексообразования. Рассмотрим на примере реакции образования гексацианоферрата (II) калия-цинка (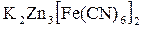 ), которая протекает по схеме
), которая протекает по схеме
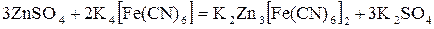 ,
,
и определим f Э гексацианоферрата калия (K4[Fe(CN)6]). В двух молях гексацианоферрата (II) калия было замещено шесть ионов калия тремя ионами цинка, следовательно, в каждой молекуле было замещено 3 иона калия, или во взаимодействии с каждой молекулой приняли участие 3 иона цинка, следовательно, 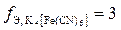 .
.
 Реакции осаждения. Разберем на примере образования сульфата бария (
Реакции осаждения. Разберем на примере образования сульфата бария ( ) по реакции
) по реакции
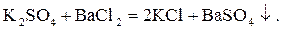
В данной реакции участвует один катион бария с зарядом иона +2 (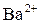 ), отсюда
), отсюда 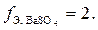
Пример 3. Вычислите эквивалентную массу Н3BO3 в следующих реакциях:
1) 2Н3BO3 + Ba(OH)2 = Ba(H2BO3)2 + 2H2O;
2) Н3BO3 + 3NaOH = Na3BO3 + 3H2O.
Решение. Эквивалентная масса сложного вещества, как и эквивалентная масса элемента, может иметь различные значения и зависит от того,
в какую химическую реакцию вступает данное вещество.
Эквивалентная масса борной кислоты (Н3BO3) равна мольной массе, деленной на число атомов водорода, замещенных в данной реакции на катион металла.
Следовательно, 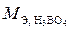 в реакции (1) равна ее мольной массе, т. к. только один ион водорода вступает во взаимодействие:
в реакции (1) равна ее мольной массе, т. к. только один ион водорода вступает во взаимодействие:
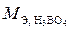 =
=  = 3 + 11 + 3∙16 = 62 г/моль,
= 3 + 11 + 3∙16 = 62 г/моль,
а в реакции (2) – три иона водорода в борной кислоте заместились на катион металла:
 .
.
Ответ. Эквивалентные массы в реакции (1) и (2) имеют разные значения. В первой реакции эквивалентная масса борной кислоты равна
62 г/моль, а во второй – 20,67 г/моль.
При решении некоторых задач, содержащих сведения об объемах газообразных веществ, целесообразно пользоваться значением эквивалентного объема (V Э).
Эквивалентным объемом называется объем одного эквивалента вещества 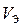 , [дм3/моль]. Имеет смысл только для газообразных веществ и может быть определен следующим образом:
, [дм3/моль]. Имеет смысл только для газообразных веществ и может быть определен следующим образом:
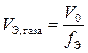
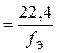 , [дм3/моль],
, [дм3/моль],
где V 0 – мольный объем газа, т. е. объем, занимаемый газом при нормальных условиях (Р 0 = 760 мм рт. ст. = 101325 Па; Т0 = 273 K), дм3;
f Э – эквивалентное число (фактор эквивалентности).
В зависимости от состава газообразного вещества эквивалентные числа определяются для:
– простых веществ – общей валентностью молекулы (например, для H2 f Э = 2; для O2 f Э = 4; для N2 f Э = 6);
– оксидов (ЭхОу) – общей валентностью кислорода, f Э = 2 у (например, для СО2 f Э = 2∙2 = 4);
– соединений с водородом (ЭНх или HxЭ) – количеством водорода,
f Э = х (например, для РН3 f Э = 3).
Например:
 дм3/моль;
дм3/моль;
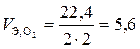 дм3/моль;
дм3/моль;
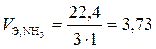 дм3/моль.
дм3/моль.
Закон эквивалентов (Рихтер, 1794 г.). Массы, объемы реагирующих веществ прямо пропорциональны их эквивалентным массам (M Э), эквивалентным объемам (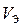 ).
).
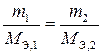 ,
, 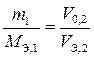 ,
,  . (1.3)
. (1.3)
Математическая запись закона эквивалентов представлена в трех вариантах через:
– массы реагирующих веществ;
– массы и объемы реагирующих веществ;
– объемы реагирующих веществ.
Пример 4. При сгорании металла массой 5,00 г образуется оксид металла массой 9,44 г. Определите эквивалентную массу металла.
Решение. Из условия задачи следует, что масса кислорода равна разности между массами оксида и металла 9,44 г – 5,00 г = 4,44 г.
Эквивалентная масса кислорода равна 8,0 г/моль. Подставляя эти значения в выражение (1.3) через массы веществ, получим:
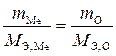 ;
; 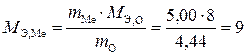 г/моль.
г/моль.
Пример 5. При окислении металла (II) массой 16,7 г образовался оксид массой 21,5 г. Вычислите эквивалентные массы металла и его оксида. Определите мольные массы металла и оксида.
Решение. Масса кислорода (m O) в оксиде составит: 21,54 – 16,74 = 4,80 г. В соответствии с законом эквивалентов определим эквивалентную массу металла, эквивалентная масса кислорода равна 8 г/моль.
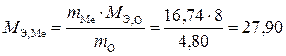 г/моль.
г/моль.
Эквивалентная масса оксида равна сумме эквивалентных масс металла и кислорода и составляет 27,90 + 8,00 = 35,90 г/моль.
Мольная масса металла (М) равна произведению эквивалентной массы на валентность, которая по условию задания равна двум:
М Me = валентность∙ М Э,Me = 2∙27,90 = 55,80 г/моль.
Мольная масса данного оксида составляет 55,80 + 16,00 = 71,8 г/моль.
Ответ. Эквивалентные массы металла и его оксида равны 27,90 и 35,90 г/моль соответственно, мольные массы – 55,80 и 71,80 г/моль.
Пример 6. Установить, из нитрата какого двухвалентного металла массой 7,27 г получается 5,22 г его хлорида.
Решение. Эквивалентные массы сложных веществ можно определять как суммы составляющих их частей.
Так, эквивалентная масса нитрата (хлорида) металла равна сумме эквивалентных масс металла (примем равной М Э,Ме = х) и кислотного остатка нитрата (хлорида):
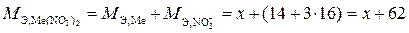 ;
;
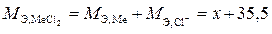 .
.
Подставим полученные выражения в формулу закона эквивалентов (1.3) и получим:
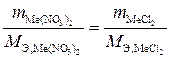 ,
, 
Отсюда: х = М Э,Ме = 32,0 г/моль.
Чтобы установить, какой металл входил в состав солей, надо определить его атомный вес. Для этого полученное значение эквивалентной массы умножить на валентность металла (по условию задачи известно, что металл двухвалентный):
А Ме = валентность∙ М Э,Ме = 2∙32,0 = 64,0 г/моль.
Ответ. Этим двухвалентным металлом является медь (Cu).
Пример 7. Из сульфата металла (II) массой 15,20 г получен гидроксид этого металла массой 9,00 г. Вычислите эквивалентную массу металла и определите формулу исходной соли.
Решение. Обозначим эквивалентную массу металла через х: М Э,Ме = х. Эквивалентную массу сульфата металла представим как сумму эквивалентных масс металла (М Э,Ме) и сульфатной группы (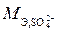 ):
):
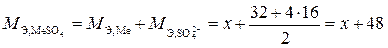 .
.
Эквивалентную массу гидроксида металла представим как сумму эквивалентной массы металла (М Э,Ме) и эквивалентной массы гидроксильной группы (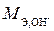 ):
):
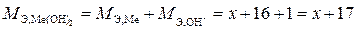 .
.
Подставим полученные выражения в формулу закона эквивалентов (1.3):
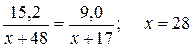 г/моль.
г/моль.
Следовательно, М Э,Ме = 28 г/моль; А Ме = 2∙28 = 56 г/моль.
Этим двухвалентным металлом является железо, т. к. его атомный вес равен 56 г/моль.
Ответ. Формула исходной соли: FeSO4; М Э,Ме = 28 г/моль.
Пример 8. В какой массе Са(ОН)2 содержится столько же эквивалентов, сколько в Аl(ОН)3 массой 312 г?
Решение. 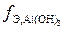 = 3 (связано с наличием трех гидроксильных групп в составе данного гидроксида), то есть
= 3 (связано с наличием трех гидроксильных групп в составе данного гидроксида), то есть 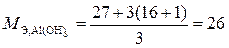 г/моль.
г/моль.
Следовательно, в 312 г Аl(ОН)3 содержится 312/26 = 12 эквивалентов.
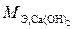 составляет 1/2 мольной массы, т. к. в составе этого основания две гидроксильные группы:
составляет 1/2 мольной массы, т. к. в составе этого основания две гидроксильные группы:
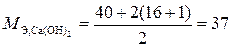 г/моль.
г/моль.
Отсюда 12 эквивалентов составляют 37∙12 = 444 г.
Ответ. В 444 г Са(ОН)2 содержится столько же эквивалентов, что и в 312 г Аl(ОН)3.
Пример 9. На восстановление оксида металла (II) массой 7,09 г требуется водород объемом 2,24 дм3 (н. у.). Вычислите эквивалентные массы оксида и металла.
Решение. В соответствии с законом эквивалентов (1.3) получим:
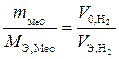 ;
; 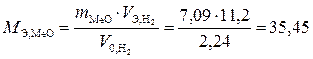 г/моль.
г/моль.
Эквивалентная масса оксида ( ) равна сумме эквивалентных масс металла и кислорода:
) равна сумме эквивалентных масс металла и кислорода:
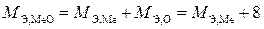 ,
,
отсюда  г/моль.
г/моль.
Ответ. Эквивалентная масса металла равна 27,45 г/моль, а его оксида 35,45 г/моль.
При определении эквивалентных масс различных веществ, по объему выделяемого газа, который собирают над водой, следует учитывать и парциальное давление газа.
Парциальным давлением газа в смеси называется давление, которое производил бы этот газ, занимая при тех же физических условиях объем всей газовой смеси. Согласно закону парциальных давлений, общее давление смеси газов, не вступающих друг с другом в химическое взаимодействие, равно сумме парциальных давлений газов, составляющих смесь. Если газ собран над жидкостью, то при расчетах следует иметь в виду, что его давление является парциальным и равно разности общего давления газовой смеси и парциального давления пара жидкости.
Пример 10. Какой объем займут при н. у. 120 см3 азота, собранного над водой при 20 оС и давлении 100 кПа (750 мм рт. ст.)? Давление насыщенного пара воды при 20 оС равно 2,3 кПа.
Решение. Парциальное давление азота равно разности общего давления и парциального давления пара воды:
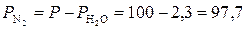 кПа.
кПа.
Обозначив искомый объем через V о и используя объединенное уравнение Бойля – Мариотта и Гей-Люссака, находим:
V 0 = PVT 0/ TP 0 = 97,7∙120∙273/293∙101,3 = 108 см3.
Ответ. Азот займет объем 108 см3.
***
36. Вычислите эквивалент и эквивалентную массу фосфорной кислоты в реакциях образования: а) гидрофосфата; б) дигидрофосфата; в) ортофосфата.
37. Определите эквивалентные массы серы, фосфора и углерода в соединениях: H2S, P2O5, CO2.
38 Избытком гидроксида калия подействовали на растворы: а) ди-гидрофосфата калия; б) дигидроксонитрата висмута (III). Напишите уравнения реакций этих веществ с гидроксидом калия и определите их эквиваленты и эквивалентные массы.
39. Напишите уравнения реакций гидроксида железа (III) с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: а) дигидроксохлорид железа; б) гидроксохлорид железа;
в) хлорид железа. Вычислите эквивалент и эквивалентную массу гидроксида железа (III) в каждой из этих реакций.
40. Вычислите эквивалентную массу серной кислоты в реакциях образования: а) сульфата; б) гидросульфата. Напишите уравнения соответствующих реакций на примере взаимодействия кислоты с KOH, Sr(OH)2.
41. Чему равен эквивалентный объем (н. у.) кислорода, водорода, хлора, аммиака, фосфина, сероводорода, оксидов азота (I) и (IV)?
42. Определите эквивалентную массу H2SO4, если известно, что серная кислота массой 98 г реагирует с магнием массой 24 г, эквивалентная масса которого равна 12 г/моль.
43. При сгорании магния массой 4,8 г образовался оксид массой 8,0 г. Определите эквивалентную массу магния.
44. При взаимодействии металла массой 2,20 г с водородом образовался гидрид массой 2,52 г. Определите эквивалентную массу металла и напишите формулу гидрида.
45. Определите эквивалентные массы олова в его оксидах, массовая доля кислорода в которых составляет 21,2 % и 11,9 %.
46. Для реакции металла массой 0,44 г потребовался бром массой 3,91 г, эквивалентная масса которого равна 79,9 г/моль. Определите эквивалентную массу металла.
47. Массовая доля кислорода в оксиде свинца составляет 7,17 %. Определите эквивалентную массу свинца.
48. Массовая доля кальция в хлориде составляет 36,1 %. Вычислите эквивалентную массу кальция, если эквивалентная масса хлора равна 35,5 г/моль.
49. Определите эквивалентную массу металла, если массовая доля серы в сульфиде составляет 22,15 %, а эквивалентная масса серы равна 16 г/моль.
50. Одна и та же масса металла соединяется с кислородом массой 0,4 г и с одним из галогенов массой 4,0 г. Определите этот галоген.
51. Рассчитайте эквивалентную массу алюминия, если при сгорании его массой 10,1 г образуется оксид массой 18,9 г.
52. На нейтрализацию щавелевой кислоты (H2C2O4) массой 1,206 г потребовалось KOH массой 1,502 г, эквивалентная масса которого равна 56 г/моль. Вычислите эквивалентную массу кислоты.
53. На нейтрализацию гидроксида массой 3,08 г израсходована хлористоводородная кислота массой 3,04 г. Вычислите эквивалентную массу гидроксида.
54. На нейтрализацию ортофосфорной кислоты массой 14,7 г израсходован NaОH массой 12,0 г. Вычислите эквивалентную массу и основность ортофосфорной кислоты. Напишите уравнение соответствующей реакции.
55. На нейтрализацию фосфористой кислоты (H3PO3) массой 8,2 г израсходован KOH массой 11,2 г. Вычислите эквивалентную массу и основность фосфористой кислоты. Напишите уравнение реакции.
56. На нейтрализацию кислоты массой 2,45 г израсходован NaOH массой 2,00 г. Определите эквивалентную массу кислоты.
57. В оксиде металла (I) массой 1,57 г содержится металл массой 1,30 г. Вычислите эквивалентную массу металла и его оксида.
58. Вычислите атомную массу металла (II) и определите, какой это металл, если данный металл массой 8,34 г окисляется кислородом объемом 0,68 дм3 (н. у.).
59. При разложении оксида металла массой 0,464 г получен металл массой 0,432 г. Определите эквивалентную массу металла.
60. Из металла массой 1,25 г получается нитрат массой 5,22 г. Вычислите эквивалентную массу этого металла.
61. При взаимодействии алюминия массой 0,32 г и цинка массой 1,16 г
с кислотой выделяется одинаковый объем водорода. Определите эквивалентную массу цинка, если эквивалентная масса алюминия равна 9 г/моль.
62. Из хлорида металла массой 20,8 г получается сульфат этого металла массой 23,3 г. Вычислите эквивалентную массу металла.
63. Из нитрата металла массой 2,62 г получается сульфат этого металла массой 2,33 г. Вычислите эквивалентную массу металла.
64. Из иодида металла массой 1,50 г получается нитрат этого металла массой 0,85 г. Вычислите эквивалентную массу металла.
65. Из сульфата металла массой 1,71 г получается гидроксид этого металла массой 0,78 г. Вычислите эквивалентную массу металла.
66. Из хлорида металла массой 1,36 г получается гидроксид этого металла массой 0,99 г. Вычислите эквивалентную массу металла.
67. Из нитрата металла массой 1,70 г получается иодид этого металла массой 2,35 г. Вычислите эквивалентную массу металла.
68. При взаимодействии металла массой 1,28 г с водой выделился водород объемом 380 см3, измеренный при 21 оС и давлении 104,5 кПа (784 мм рт. ст.). Рассчитайте эквивалентную массу металла.
69. Какой объем водорода (н. у.) потребуется для восстановления оксида металла массой 112 г, если массовая доля металла в оксиде составляет 71,43 %? Определите эквивалентную массу металла.
70. Эквивалентная масса металла равна 23 г/моль. Определите массу металла, которую нужно взять для выделения из кислоты водорода объемом 135,6 см3 (н. у.).
71. Вычислите эквивалентную массу металла, если металл массой 0,5 г вытесняет из кислоты водород объемом 184 см3, измеренный при 21 °С и давлении 101325 Па.
72. Вычислите эквивалентную массу металла, если металл (II) массой 1,37 г вытесняет из кислоты водород объемом 0,5 дм3, измеренный при 18 оС и давлении 101325 Па.
73. Определите эквивалентную и атомную массы металла (II), если при реакции металла массой 0,53 г с HCl получен H2 объемом 520 см3 при 16 оС и давлении 748 мм рт. ст. Давление насыщенного водяного пара при данной температуре равно 13,5 мм рт. ст.
74. Металл (II) массой 0,604 г вытеснил из кислоты водород объемом 581 см3, измеренный при 18 оС и давлении 105,6 кПа и собранный над водой. Давление насыщенного пара воды при данной температуре равно 2,1 кПа. Рассчитайте атомную массу металла.
75. В газометре над водой находится О2 объемом 7,4 дм3 при 296 К и давлении 104,1 кПа (781 мм рт. ст.). Давление насыщенного водяного пара при этой температуре равно 2,8 кПа (21 мм рт. ст.). Какой объем (н. у.) займет находящийся в газометре кислород?
76*. Элементы А и В, расположенные в одном периоде системы элементов Д. И. Менделеева, образуют между собой соединение, содержащее 79,77 % элемента В (по массе). При гидролизе этого соединения выделяется газ, обладающий кислотными свойствами и содержащий 2,74 % водорода и 97,26 % элемента В (по массе). Выведите молекулярную формулу соединения А с В и напишите уравнение реакции его гидролиза.
Дата публикования: 2015-10-09; Прочитано: 8961 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
