 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Кинетика химических реакций
|
|
Различают реакции гомогенные и гетерогенные. Гомогенные реакции протекают в системе, состоящей из одной фазы. Примерами гомогенной системы являются: любая газовая смесь, раствор нескольких веществ в одном растворителе и т. п. Такие реакции протекают одновременно по всему объему системы.
Гетерогенные реакции протекают в системе, состоящей из нескольких фаз. Примером гетерогенной системы является вода со льдом или уголь
в атмосфере кислорода. Если реакция протекает между веществами, образующими гетерогенную систему, то она может идти только на поверхности раздела фаз, образующих систему. Так, при растворении металла в кислоте

реакция может протекать только на поверхности металла, потому что только здесь соприкасаются друг с другом оба реагирующих вещества.
Под скоростью химической реакции (v) понимают изменение концентрации реагирующих веществ или продуктов реакции в единицу времени
в единице объема системы (для гомогенной реакции) или на единицу площади раздела фаз (для гетерогенной реакции).
Концентрацию принято выражать числом молей вещества в 1 л раствора, а время – в секундах, минутах, часах в зависимости от продолжительности процесса.
Скорость химических реакций зависит от природы реагирующих веществ, концентрации, температуры, давления, присутствия катализатора.
Необходимым условием для того, чтобы между частицами исходных веществ произошло химическое взаимодействие, является их столкновение друг с другом. Число соударений тем больше, чем выше концентрация каждого из исходных веществ. Зависимость скорости реакции от концентрации реагирующих веществ определяется основным законом кинетики – законом действующих масс, согласно которому скорость химической реакции, протекающей при постоянной температуре в гомогенной системе, пропорциональна произведению концентраций реагирующих веществ, возведенных в степень их стехиометрических коэффициентов.
Для реакции
аА + bB = cC + dD
зависимость скорости реакции определяется следующим образом:
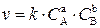 ,
,
где k – константа скорости реакции;
С А, С В – концентрации реагирующих веществ А и В, моль/л;
а, b – стехиометрические коэффициенты.
Константа скорости реакции (k) показывает, чему равна скорость реакции в тот момент, когда концентрации реагирующих веществ равны 1 моль/л (если С А = С В = 1 моль/л, то v = k).
Например, для гомогенной реакции
2H2 (г) + O2 (г) = 2H2O (г)
 .
.
Для гетерогенной реакции образования газа фосфина (PH3)
2P (т) + 3H2 (г) = 2PH3 (г)
выражение скорости реакции можно записать как
 ,
,
то есть в уравнение закона действующих масс входят концентрации только газообразных или жидких веществ. Так как реакции с участием твердых веществ протекают лишь на поверхности раздела фаз, концентрация твердого вещества за данный отрезок времени остается практически постоянной и не входит в выражение скорости реакции.
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа: при повышении температуры на каждые 10 °С скорость большинства химических реакций увеличивается в 2–4 раза, и наоборот, при понижении температуры – понижается соответственно во столько же раз.
 ,
,
где 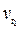 ,
, 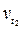 – скорости реакции при температуре t1 и t2;
– скорости реакции при температуре t1 и t2;
γ – температурный коэффициент скорости реакции.
Величина γ показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10 °С.
Химические реакции можно квалифицировать по признаку обратимости процесса. Необратимыми называются такие реакции, которые протекают до конца, то есть до полного расходования одного из реагирующих веществ, например:
 .
.
Химические реакции, протекающие при данных условиях во взаимно противоположных направлениях, называются обратимыми, например:
3H2 (г) + N2 (г)↔ 2NH3 (г).
Реакцию, протекающую в правую сторону (→), называют прямой,
а в левую (←) – обратной.
Обратимые реакции не доходят до конца, а заканчиваются установлением химического равновесия.
Химическое равновесие – это такое состояние системы, когда скорости прямой (v →) и обратной (v ←) реакции становятся равными.
Таким образом, кинетическим условием химического равновесия является равенство
v → = v ←.
Если равенство v → = v ← является кинетическим условием химического равновесия, то равенство
Δ G P,T = 0
– термодинамическим условием химического равновесия.
Количественно химическое равновесие оценивают по величине константы химического равновесия (K р).
Рассмотрим обратимую гомогенную реакцию:
аA + bB ↔ сC + dD.
Отношение произведения концентраций продуктов реакции к произведению концентраций исходных веществ, взятых в степенях их стехиометрических коэффициентов, есть величина постоянная и называемая константой химического равновесия:
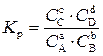 .
.
Например, для гомогенной реакции
3H2 (г)+ N2 (г)↔ 2NH3 (г)
выражение константы равновесия будет иметь вид
 ,
,
или через парциальные давления имеющихся в равновесной системе газообразных веществ
 .
.
В случае реакций, протекающих в гетерогенной среде, константу равновесия определяют, используя значения концентраций только тех веществ, которые находятся в газообразном или жидком состоянии, например:
CO2 (г) + C (т) = 2CO (г);
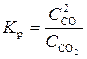 , или
, или  .
.
Константа равновесия имеет большое теоретическое и практическое значение. По ее величине можно судить о полноте протекания реакции. Если  > 1, то равновесие смещается в сторону прямой реакции, если
> 1, то равновесие смещается в сторону прямой реакции, если
 < 1 – в сторону обратной реакции. Следовательно, численные значения
< 1 – в сторону обратной реакции. Следовательно, численные значения  позволяют судить о сдвиге химического равновесия в ту или иную сторону.
позволяют судить о сдвиге химического равновесия в ту или иную сторону.
Состояние химического равновесия сохраняется до тех пор, пока не изменяются условия. При изменении внешних условий равновесие нарушается, и через некоторое время система перейдет в новое состояние.
Переход системы из одного равновесного состояния в другое называется смещением или сдвигом равновесия.
На смещение равновесия оказывают влияние следующие факторы:
– концентрация исходных веществ или продуктов;
– температура процесса;
– давление в системе.
При смещении равновесия, вызванном изменением концентраций
и давления, константа равновесия остается постоянной; при изменении температуры константа равновесия меняется.
Направление смещения равновесия в результате изменения внешних условий описывает принцип Ле Шателье:
если на систему, находящуюся в состоянии химического равновесия, оказывать какое-либо воздействие (изменять концентрацию, температуру, давление), то равновесие смещается в направлении той реакции, которая способствует ослаблению этого воздействия.
Рассмотрим влияние изменений концентраций, давления и температуры на сдвиг химического равновесия.
При увеличении концентрации хотя бы одного из реагентов равновесие смещается в сторону образования продуктов реакции, а при добавлении продуктов – в сторону реагентов.
Например, в реакции 2NO (г) + O2 (г) = 2NO2 (г) повышение концентрации C NO в момент равновесия приводит к смещению равновесия в направлении прямого процесса, понижение концентрации  также смещает равновесие в сторону прямой реакции.
также смещает равновесие в сторону прямой реакции.
Изменение давления вызывает смещение равновесия только в реакциях с участием газообразных веществ и только в тех, где суммы стехиометрических коэффициентов в левой и правой частях уравнения реакции не равны.
При увеличении давления в системе равновесие сдвигается в сторону уменьшения числа молей газообразных веществ, при уменьшении давления в системе равновесие сдвигается в сторону возрастания числа молей газообразных веществ. Например, газообразная система
N2 (г) + 3H2 (г) ↔ 2NH3 (г)
находится в равновесии при определенной температуре. Не изменяя температуру, увеличим давление в системе в два раза, то есть уменьшим объем в два раза; равновесие сместится в сторону прямой реакции, так как 4 моля исходных газообразных веществ занимают при одних и тех же условиях больший объем, чем 2 моля продукта реакции.
При изменении температуры фактором, который определяет направление смещения равновесия, является знак теплового эффекта реакции. При повышении температуры равновесие смещается в направлении эндотермической (Q < 0), а при понижении – экзотермической реакции (Q > 0).
В реакции
 кДж
кДж
повышение температуры сместит равновесие в сторону прямой (эндотермической) реакции.
Пример 1. Как изменится скорость реакции:
2NO (г) + O2 (г) = 2NO2 (г),
если: а) уменьшить объем реакционного сосуда в три раза;
б) увеличить давление в системе в 2 раза?
Решение. а) До изменения объема, согласно закону действия масс, скорость реакции выражалась уравнением
 .
.
Вследствие уменьшения объема концентрация каждого из реагирующих веществ возрастет в три раза. Следовательно, теперь

 .
.
Сравнивая выражения для  и v, находим, что скорость реакции увеличится в 27 раз:
и v, находим, что скорость реакции увеличится в 27 раз:
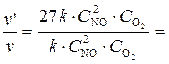 27 раз.
27 раз.
б) Вследствие увеличения давления в системе в 2 раза объем газовой смеси уменьшится в 2 раза, а концентрация каждого из реагирующих веществ возрастет в 2 раза. Следовательно:
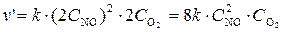 .
.
Сравнивая выражения для  и v, находим
и v, находим
 8 раз.
8 раз.
Скорость реакции в этом случае увеличится в 8 раз.
Ответ: а) скорость реакции возрастет в 27 раз;
б) скорость реакции возрастет в 8 раз.
Пример 2. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз изменится скорость реакции при повышении температуры от 20 до 75 oС?
Решение. Поскольку 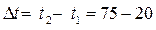 = 55 oC, то, обозначив скорость реакции при 20 и 75 oC соответственно через
= 55 oC, то, обозначив скорость реакции при 20 и 75 oC соответственно через 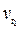 и
и  , можем записать правило Вант-Гоффа как
, можем записать правило Вант-Гоффа как
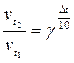 ;
;
логарифмируя
lg  ,
,
получим 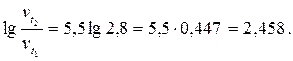
Отсюда  .
.
Ответ. Скорость реакции увеличится в 287 раз.
Пример 3. Рассчитайте изменение константы скорости реакции, имеющей энергию активации 191 кДж/моль, при увеличении температуры от 330 до 400 К.
Решение. Зависимость константы скорости от температуры реакции определяется уравнением Аррениуса
 или
или 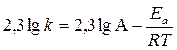 .
.
Логарифм отношения констант скоростей реакции при температурах Т 2 и Т 1 соответственно равен
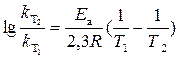 ,
,
где R – универсальная газовая постоянная, равная 8,3144 Дж/(моль·К). Подставив в это уравнение данные задачи, получим
 .
.
Отсюда 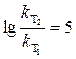 , а
, а  .
.
Ответ. Константа скорости реакции при увеличении температуры
от 330 до 400 К увеличится в 100000 раз.
Пример 4. Рассчитайте константу равновесия химической реакции при 1000 К, если стандартная энергия Гиббса при этой температуре равна Δ G 0 = –191 кДж/моль.
Решение. Константа равновесия химической реакции связана с энергией Гиббса уравнением
Δ G 0 = – RT ln K p = –2,3 RT lg K p,
решаем относительно K p:
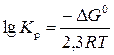 .
.
Подставив в это уравнение численные значения, получим
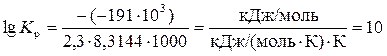 , а K p= 1010.
, а K p= 1010.
Ответ. Константа равновесия данной реакции при температуре 1000 К составляет 1010.
Пример 5. В каком направлении сместится равновесие в системах:
а) CO (г) + Cl2 (г) = COCl2 (г);
б) Н2 (г) + I2 (г) = 2НI (г),
если при неизменной температуре увеличить давление путем уменьшения объема газовой смеси?
Решение. а) Протекание реакции в прямом направлении приводит
к уменьшению общего числа молей газа (из двух молей газообразных веществ образуется только один), т. е. к уменьшению давления в системе. Поэтому, согласно принципу Ле Шателье, повышение давления вызовет смещение равновесия в сторону прямой реакции.
б) Протекание реакции не сопровождается изменением числа молей газов (из двух молей газообразных веществ образуется два моля продуктов) и не приводит, следовательно, к изменению давления. В этом случае изменение давления не вызовет смещения равновесия.
Пример 6. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению
PCl5 (г) = PCl3 (г) + Cl2 (г); 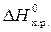 = 92,59 кДж.
= 92,59 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложения PCl5?
Решение. Направление смещения химического равновесия определяется по принципу Ле Шателье:
а) если реакция разложения PCl5 идет с поглощением теплоты (эндотермическая), то для смещения равновесия в сторону прямой реакции необходимо повысить температуру;
б) если разложение PCl5 приводит к увеличению объемов газов
(из одной молекулы газа PCl5 образуются две газообразные молекулы PCl3 и Cl2), то для смещения равновесия необходимо уменьшить давление;
в) смещения равновесия в указанном направлении можно достичь как увеличением концентрации PCl5, так и уменьшением концентрации PCl3 и/или Cl2.
Пример 7. Реакция протекает по уравнению
4HCl (г) + O2 = 2H2O (г) + 2Cl2.
В каком направлении сместится химическое равновесие, если концентрацию всех реагирующих веществ увеличить в 2 раза?
Решение. Первоначальные скорости прямой и обратной реакции были следующие:
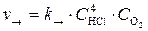 ;
; 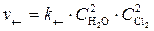 .
.
После увеличения концентраций скорость прямой реакции стала
 ,
,
т. е. возросла в 32 раза, а скорость обратной реакции –
 ,
,
возросла в 16 раз. Следовательно, равновесие сместится в сторону прямой реакции.
Ответ. Равновесие сместится в сторону прямой реакции – образования молекулярного хлора и паров воды.
Пример 8. В какую сторону сместится химическое равновесие реакции АВ = А + В, если повысить температуру на 30 оС? Температурные коэффициенты прямой и обратной реакций соответственно равны 2 и 3.
Решение. Решение этой задачи основывается на зависимости скорости реакции от температуры по правилу Вант-Гоффа.
При повышении температуры на 30 оС скорость прямой реакции возрастет в
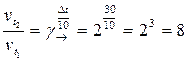 раз,
раз,
а скорость обратной реакции – в
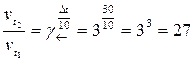 раз.
раз.
Таким образом, равновесие этой реакции при повышении температуры смещается в сторону образования веществ АВ, так как скорость обратной реакции возрастет в 27 раз, а прямой – только в 8.
Ответ. Равновесие сместится в сторону обратной реакции – образования вещества АВ.
***
1. Окисление серы и ее оксидов протекает по уравнениям:
а) S (т) + O2 = SO2 (г);
б) 2SO2 (г) + O2 = 2SO3 (г).
Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в 4 раза?
2. Реакция идет по уравнению
2NO + O2 = 2NO2.
Концентрации исходных веществ были: C NO = 0,03 моль/дм3,
 = 0,05 моль/дм3. Как изменится скорость реакции, если увеличить концентрацию кислорода до 0,1 моль/дм3, а NO до 0,06 моль/дм3?
= 0,05 моль/дм3. Как изменится скорость реакции, если увеличить концентрацию кислорода до 0,1 моль/дм3, а NO до 0,06 моль/дм3?
3. Реакция идет по уравнению
N2 + O2 = 2NO.
Концентрации исходных веществ до начала реакции были:
 = 0,049 моль/дм3;
= 0,049 моль/дм3;  = 0,01 моль/дм3. Вычислите концентрации этих веществ в момент, когда концентрация NO стала равной 0,005 моль/дм3.
= 0,01 моль/дм3. Вычислите концентрации этих веществ в момент, когда концентрация NO стала равной 0,005 моль/дм3.
4. Начальные концентрации веществ, участвующие в образовании аммиака, равны:  = 0,8 моль/дм3;
= 0,8 моль/дм3;  = 1,5 моль/дм3. Определите концентрации N2 и H2 в тот момент, когда образовалось 0,1 моль/дм3 NH3.
= 1,5 моль/дм3. Определите концентрации N2 и H2 в тот момент, когда образовалось 0,1 моль/дм3 NH3.
5. Реакция идет по уравнению H2 + I2 = 2HI, константа скорости этой реакции при 508 оС равна 0,16. Исходные концентрации реагирующих веществ были: 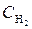 = 0,04 моль/дм3;
= 0,04 моль/дм3;  = 0,05 моль/дм3. Вычислите начальную скорость реакции и скорость, когда
= 0,05 моль/дм3. Вычислите начальную скорость реакции и скорость, когда 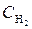 стала равной 0,03 моль/дм3.
стала равной 0,03 моль/дм3.
6. В гомогенной системе CO + Cl2 = COCl2 концентрацию CO увеличили с 0,3 до 1,2 моль/дм3, а концентрацию Cl2 – с 0,2 до 0,6 моль/дм3. Во сколько раз возросла скорость прямой реакции?
7. Как изменится скорость химической реакции
2Fe (т) + 3Cl2 (г) = 2FeCl3 (т),
если давление системы увеличить в 6 раз?
8. Во сколько раз нужно увеличить давление, чтобы скорость образования NO2 по реакции 2NO + O2 = 2NO2 возросла в 1000 раз?
9. Написать выражение скорости химической реакции, протекающей
в гомогенной системе А + 2В2 = С, и определить, во сколько раз изменится скорость реакции, если:
а) концентрацию А увеличить в 4 раза;
б) концентрацию В2 уменьшить в 3 раза;
в) концентрацию А и В2 увеличить в 2 раза.
10. Скорость химической реакции задается уравнением:
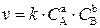 .
.
Если С А увеличить в 2 раза (при неизменной концентрации В), скорость реакции увеличивается в 8 раз. Если концентрацию В увеличить
в 2 раза (при неизменной концентрации А), скорость реакции возрастает
в 2 раза. Определите показатели степеней a и b в уравнении скорости реакции.
11. При постоянной температуре за одинаковое время в сосудах одной формы и емкости образовалось: 17 г H2S; 18 г H2O; 18 г H2 и 16 г SO2. Расположите вещества в порядке увеличения скорости их образования.
12. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80 оС. Температурный коэффициент скорости реакции равен 3.
13. При 80 оС некоторая реакция заканчивается за 16 мин. Сколько потребуется времени для проведения этой реакции:
а) при 100 оС;
б) при 60 оС?
Температурный коэффициент данной реакции равен 2.
14. При увеличении температуры на 50 оС скорость реакции возросла в 1024 раза. Вычислите температурный коэффициент реакции.
15. Вычислите, при какой температуре реакция закончится за 45 мин, если при 293 К на это требуется 3 ч. Температурный коэффициент скорости реакции равен 3,2.
16. На сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент равен 2,7.
17. Определить температурный коэффициент скорости реакции, если при понижении температуры на 45 оС реакция замедлилась в 25 раз.
18. Константы скорости некоторой реакции при 273 и 295 К равны соответственно 1,17 и 6,56 моль/дм3·мин. Найдите температурный коэффициент скорости реакции.
19. Во сколько раз увеличится скорость химической реакции А + 2В = С при увеличении давления в системе в 4 раза и одновременном повышении температуры на 40 оС? Реагирующие вещества – газы. Температурный коэффициент скорости реакции равен 2.
20. Во сколько раз уменьшится скорость реакции
2А (г) + В (г) = С (г)
при уменьшении парциального давления всех веществ в системе в три раза и одновременном понижении температуры системы на 30 оС? Температурный коэффициент скорости реакции равен 2.
21. Вычислите энергию активации реакции разложения диоксида азота
2NO2 = 2NO + O2,
если константы скорости этой реакции при 600 и 640 К соответственно равны 83,9 и 407,0 моль/дм3·мин.
22. Энергия активации реакции разложения
2N2O5 = 4NO2 + O2
равна 103,5 кДж/моль. Константа скорости этой реакции при 298 К равна 2,03·10–3 с–1. Вычислите константу скорости этой реакции при 288 К.
23. Во сколько раз изменится константа скорости реакции при увеличении температуры от 500 до 1000 К, если энергия активации равна
95,5 кДж/моль?
24. Определите энергию активации реакции, если при изменении температуры от 330 до 400 К константа скорости реакции увеличилась
в 105 раз.
25. Напишите выражение для константы равновесия гетерогенной системы: C + H2O (г) = CO + H2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образования водяных паров?
26. Исходные концентрации NO и Cl2 в гомогенной системе
2NO + Cl2 = 2NOCl
составляют соответственно 0,5 и 0,2 моль/дм3. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20 % NO.
27. Константа равновесия гомогенной системы
CO (г) + H2O (г) = CO2 (г) + H2
при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации 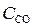 = 0,10 моль/дм3;
= 0,10 моль/дм3; 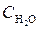 = 0,40 моль/дм3.
= 0,40 моль/дм3.
28. Исходная смесь состоит из 0,30 моль/дм3 H2 и 0,20 моль/дм3 N2. Равновесие наступит, когда прореагирует 0,24 моль/дм3 H2. Вычислите константу равновесия химической реакции N2 + 3H2 = 2NH3 (г).
29. Рассчитайте константу равновесия  химической реакции при температуре 300 К, если стандартная энергия Гиббса реакции при этой температуре равна –57,3 кДж/моль.
химической реакции при температуре 300 К, если стандартная энергия Гиббса реакции при этой температуре равна –57,3 кДж/моль.
30. Определите стандартную энергию Гиббса химической реакции при 1000 К, если константа равновесия  равна 1010.
равна 1010.
31. Как повлияет на состояние равновесия системы
4HCl (г) + O2 = 2H2O (г) + 2Cl2 (г); 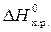 < 0
< 0
повышение давления и температуры?
32. Вычислите равновесные концентрации H2 и I2 в реакции
H2 + I2 = 2HI,
если их начальные концентрации составляли по 0,03 моль/дм3, а равновесная концентрация HI – 0,04 моль/дм3. Вычислите константу равновесия данной реакции.
33. Исходная концентрация каждого из веществ в смеси составляет
1 моль/дм3:
А + В = С + D.
После установления равновесия концентрация вещества D составляет 0,5 моль/дм3. Вычислите величину константы равновесия.
34. В состоянии равновесия системы
CO2 + H2 = CO + H2O (г)
реакционная смесь имела следующий объемный состав: 22 % CO2, 41 % H2, 17 % СО, 20 % H2O. Вычислите константу равновесия реакции, если общее давление в системе при 298 К составляет 105 Па.
35. Даны системы:
а) 2H2O (г) = 2H2 + O2;
б) N2 + 3H2 = 2NH3 (г);
в) CaCO3 (т) = CaO (т) + CO2;
г) CO + H2O (г) = CO2 + H2.
Определите, в какой из систем равновесие смещается:
а) при повышении давления в сторону прямой реакции;
б) при повышении давления в сторону обратной реакции;
в) изменение давления не сказывается на смещении равновесия.
36. Как повлияет понижение температуры и давления на равновесие следующих обратимых реакций:
а) N2O4 = 2NO2 – 58,4 кДж;
б) N2 + 3H2 = 2NH3; 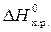 = –92,4 кДж;
= –92,4 кДж;
в) CO + H2O (г) = CO2 + H2; 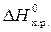 = –41,2 кДж;
= –41,2 кДж;
г) COCl2 = CO + Cl2; 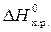 = 112,5 кДж;
= 112,5 кДж;
д) 2NO + O2 = 2NO2 + 113,0 кДж?
37. В каком направлении будет смещаться равновесие реакции
CH4 + H2O (г) = CO + 3H2
при уменьшении объема системы в 3 раза?
38. В каком направлении сместится равновесие реакции
2CO + 2H2 = CH4 + CO2,
если концентрации всех реагирующих веществ уменьшить в 3 раза?
39. В какую сторону сместится равновесие реакции:
2А = 2С + D + Q,
если понизить температуру на 30 оС, температурные коэффициенты прямой и обратной реакций соответственно равны 2,7 и 3,3?
40*. Константа равновесия реакции H2 + I2 = 2HI зависит от температуры следующим образом:
 .
.
Рассчитайте равновесный состав смеси (в мол. %) при Т = 1000 К, если водород и йод взяты в эквимольных соотношениях. Рассчитайте  при этой температуре.
при этой температуре.
41*. В реакции А + В = АВ начальная скорость измерялась при различных исходных концентрациях. Были получены следующие данные:
| С o, А, моль/дм3 | С o, В, моль/дм3 | v, моль/дм3∙с |
| 1,0 | 1,0 | 0,025 |
| 0,1 | 1,0 | 0,0025 |
| 1,0 | 0,1 | 0,00025 |
Найдите частные порядки (а, b) по реагентам А и В и напишите уравнения скорости реакции.
42*. В реакции АВ2 «А + 2В все вещества являются идеальными газами. 10-литровый сосуд содержал 0,4 моль АВ2. Затем был введен катализатор разложения. После достижения равновесия давление смеси составило 1,2 атм при температуре 300 К. Рассчитайте K р для данной реакции при 300 К.
44*. Рассчитайте равновесный состав (мол. %) водяного пара (газа), образованного при Т = 1396 К из равных объемов монооксида углерода и паров воды по уравнению
CO + H2O (г) «CO2 + H2.
При указанной температуре и давлении 1 атм степень диссоциации CO2 на монооксид углерода и кислород равна 1,44∙10–4, а степень диссоциации паров воды на водород и кислород при тех же условиях равна 8,3∙10–5.
Дата публикования: 2015-10-09; Прочитано: 3223 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
