 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Энергетика химических реакций
|
|
Химические реакции сопровождаются энергетическими эффектами (выделение или поглощение тепловой, световой, механической, электрической энергий). Количество тепла, поглощаемое или выделяемое в процессе химической реакции, называется тепловым эффектом реакции Q, кДж/моль или кДж.
Если процесс идет с выделением тепла (экзотермический), тепловой эффект условно берется со знаком плюс (+ Q), если тепло поглощается (эндотермический процесс) – со знаком минус (– Q).
При записи термохимических уравнений реакций указывается тепловой эффект с соответствующим знаком, агрегатное состояние вещества; допускаются дробные коэффициенты:
H2 (г) + 1/2O2 (г) = H2О (ж) + 285,8 кДж/моль.
Энергетическое состояние химической системы описывается следующими функциями: U – внутренняя энергия; Н – энтальпия; S – энтропия;
G – свободная энергия системы (энергия Гиббса, или изобарно-изотермический потенциал).
Значения этих функций связаны с особенностями состава, внутреннего строения вещества, а также с внешними условиями протекания процесса: давлением, температурой, концентрацией вещества.
Внутренняя энергия U химической системы – это полная энергия системы, включающая энергию движения атомов и молекул, электронов и ядер в атомах, внутриядерную энергию, энергию межмолекулярного взаимодействия и другие виды энергий, за исключением кинетической и потенциальной энергии системы как целого:
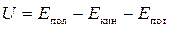 .
.
Абсолютную величину запаса внутренней энергии химической системы замерить невозможно. Определяют изменение внутренней энергии системы при переходе ее из начального в конечное состояние (из исходных веществ в продукты реакции):
∆  .
.
Если процесс идет с поглощением тепла, внутренняя энергия возрастает, если с выделением, то уменьшается.
Например, процесс протекает при постоянном объеме V = const.
H2SO4 (ж) + Zn (к) = ZnSO4 (ж) + H2 (г) + QV.
∆ 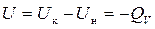 , так как
, так как 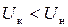 .
.
Следовательно, для изохорных процессов
∆ 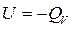 .
.
Если тот же процесс протекает при постоянном давлении Р = const, то 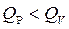 , так как система расширяется, то есть совершает работу над внешней средой:
, так как система расширяется, то есть совершает работу над внешней средой:
Q p = QV – A = QV – P∆ V,
где Р – давление внешней среды; А – работа, совершенная системой; Δ V – изменение объёма системы.
Сделав некоторые преобразования, получим:
Q p = ∆ U – P∆ V;
– Q p = ∆ U + P∆ V = ∆ H.
Энтальпия системы 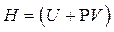 – это энергия расширенной системы. Следовательно, ∆
– это энергия расширенной системы. Следовательно, ∆  .
.
Для экзотермических процессов ∆ 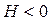 .
.
Для эндотермических ∆ 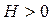 .
.
Энтальпией образования сложного соединения 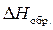 называется изменение энтальпии в процессе получения одного моля этого соединения из простых веществ, находящихся в устойчивом агрегатном состоянии при данных условиях.
называется изменение энтальпии в процессе получения одного моля этого соединения из простых веществ, находящихся в устойчивом агрегатном состоянии при данных условиях.
Обычно энтальпию образования различных соединений 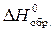 оценивают в стандартных условиях:
оценивают в стандартных условиях:
t 0 = 25 oC (298 K); P 0 = 1 атм (101325 Па); C вещ. = 1 моль/л.
Например, для процесса Ca (т) + 1/2O2 (г) = CaO (т); ∆ H 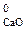 = –635 кДж/моль, стандартные энтальпии образования простых веществ принимают равными нулю: ∆ H
= –635 кДж/моль, стандартные энтальпии образования простых веществ принимают равными нулю: ∆ H  = 0; ∆ H
= 0; ∆ H 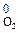 = 0.
= 0.
Термохимические расчёты основаны на следствии из закона Гесса: изменение энтальпии химической реакции равно сумме энтальпий образования продуктов реакции за вычетом сумм энтальпий образования исходных веществ с учётом стехиометрических коэффициентов.
∆ 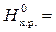 ∑∆ H
∑∆ H  – ∑∆ Н
– ∑∆ Н 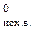 .
.
Данное следствие применяется для расчетов всех термодинамических функций при стандартных условиях:
∆ 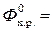 ∑∆ Ф
∑∆ Ф 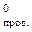 – ∑∆ Ф
– ∑∆ Ф 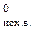 ,
,
где Ф – термодинамические функции: U, H, S, C p, G.
Например, для реакции
CH4 (г) + 2O2 (г) = 2H2O (ж) + CO2 (г);
∆ 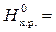 ∆ Н
∆ Н 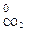 + 2∆ Н
+ 2∆ Н 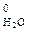 (ж) – ∆ Н
(ж) – ∆ Н 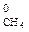 .
.
Большинство химических процессов протекают самопроизвольно
в сторону уменьшения запаса внутренней энергии или энтальпии системы. Но известны и такие процессы, которые протекают самопроизвольно без изменения внутренней энергии системы, движущей силой таких процессов является энтропия S системы. Энтропия характеризует беспорядок в системе, чем выше беспорядок, тем выше энтропия. В изолированных от внешней среды системах процессы протекают самопроизвольно в направлении увеличения энтропии (∆ 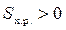 ).
).
Энтропия реакции рассчитывается по следствию из закона Гесса и имеет единицу измерения Дж/моль·K:
∆ 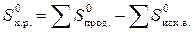
Таким образом, существуют два основных фактора самопроизвольного протекания процессов:
1) уменьшение внутренней энергии или энтальпии системы ( ; ∆
; ∆ 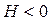 );
);
2) увеличение беспорядка или энтропии системы (∆ 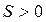 ).
).
В термодинамике существует параметр, который отражает влияние на направление процесса двух рассмотренных факторов одновременно. Таким параметром для процессов, протекающих при постоянных температуре и давлении, является изобарно-изотермический потенциал G (или энергия Гиббса, свободная энергия системы). Изменение изобарно-изотермического потенциала химической реакции можно рассчитать по формуле Гиббса:
∆ G T,х.р. = Δ 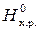 – T ∆
– T ∆ 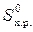 ,
,
где T – абсолютная температура процесса, K.
∆ G х.р. характеризует общую движущую силу процесса. Если процесс протекает в стандартных условиях, то ∆ 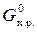 рассчитывается по следствию из закона Гесса. Величина и знак ∆
рассчитывается по следствию из закона Гесса. Величина и знак ∆ 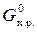 характеризуют принципиальную возможность протекания процесса. Если ∆
характеризуют принципиальную возможность протекания процесса. Если ∆ 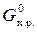 < 0, процесс протекает самопроизвольно при данных условиях.
< 0, процесс протекает самопроизвольно при данных условиях.
Пример 1. Пользуясь данными таблицы 4 (приложение), вычислите Δ H 0 реакции:
2Mg (т) + СО2 (г) = 2МgО (т) + С (графит).
Решение. Стандартные энтальпии образования СО2 (г) и МgО (т) равны соответственно –393,51 и –601,49 кДж/моль, а стандартные энтальпии образования простых веществ равны нулю.
Δ H 0 реакции находим по уравнению:
∆ 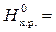 ∑∆ H
∑∆ H  – ∑∆ Н
– ∑∆ Н 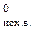 .
.
∆  кДж.
кДж.
Ответ. Изменение энтальпии данной реакции равно –809,47 кДж.
Пример 2. Рассчитайте теплоту сгорания метана и количество теплоты, которое выделится при сгорании 100 дм3 этого вещества.
Решение. 1. Под теплотой сгорания вещества подразумевают тепловой эффект реакции окисления одного моля этого соединения. В случае органического соединения продуктами окисления обычно бывают СО2 (г) и Н2О (г).
Реакцию сгорания метана можно представить уравнением
СН4 (г) + 2О2 (г) = СО2 (г) + 2Н2О (г).
2. Используя следствие из закона Гесса и стандартные энтальпии образования веществ (приложение 2), вычислим изменение энтальпии при протекании данной реакций:
 .
.
3. Т. к. Δ Η 0 = – Q, следовательно, при сгорании одного моля СН4 выделяется 802,32 кДж теплоты.
4. Определим, сколько молей составляет 100 дм3 метана:
n (СН4) = V / V 0 = 100/22,4 = 4,46 моль.
5. Количество теплоты при сгорании 4,46 моль составит 4,46∙802,32 = = 3578,35 кДж.
Ответ. При сгорании 100 дм3 метана выделяется 3578,35 кДж теплоты.
Пример 3. Какое количество теплоты выделяется при сгорании 20 г метана в потоке углекислого газа?
Решение. 1. Реакция горения метана протекает следующим образом:
CH4 (г) + CO2 (г) = 2CO (г) + 2H2 (г).
2. Для ответа на вопрос следует вычислить тепловой эффект данного химического процесса по следствию из закона Гесса
∆ 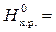 ∑∆ H
∑∆ H  – ∑∆ Н
– ∑∆ Н 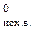 .
.
Теплоты образования простых веществ равны нулю: ∆ 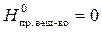 . Значения теплот образования сложных веществ возьмем в приложении 2. Подставим значения и получим:
. Значения теплот образования сложных веществ возьмем в приложении 2. Подставим значения и получим:
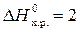 ∆ Н
∆ Н  ;
;
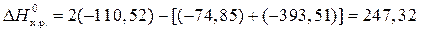 кДж;
кДж;
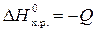 = –247,32 кДж.
= –247,32 кДж.
Такое количество теплоты поглощается при сгорании 1 моля, т. е. 16 г метана.
3. Определим, какое количество теплоты поглощается при сгорании 20 г метана, для этого составим пропорцию:
16 г – (–247,32) кДж
20 г – х кДж
х = 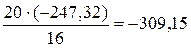 кДж.
кДж.
Ответ. При сгорании 20 г метана поглощается 309,15 кДж теплоты.
Пример 4. В процессе получения меди в промышленности используется реакция угля с оксидом меди (II): C + CuO = Cu + CO. Теплота, необходимая для осуществления процесса, обеспечивается горением углерода. Сколько потребуется углерода для получения 1280 г меди? Потерями углерода на побочные процессы пренебречь.
Решение. 1. Определим, сколько требуется теплоты для получения 1 моля меди по указанной реакции (теплоты образования CuO и CO возьмем из приложения 2).
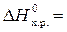 ∆ Н
∆ Н 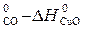 ;
;
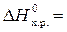 –110,53 – (–165,30) = 54,77 кДж.
–110,53 – (–165,30) = 54,77 кДж.
2. Найдем, сколько молей составляет 1280 г меди:
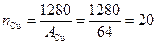 моль.
моль.
Следовательно, необходимо и 20 моль углерода, т. е. m C = n ∙ А С = 20·12 = = 240 г.
3. Вычислим, сколько потребуется теплоты для получения 20 молей меди: Q = n ∙(– 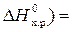 20·(–54,77) = –1095,4 кДж.
20·(–54,77) = –1095,4 кДж.
4. Вся необходимая теплота для осуществления процесса выделяется при реакции горения углерода согласно термохимическому уравнению:
C + O2 = CO2; 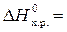
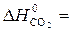 –393,51 кДж,
–393,51 кДж,
для выделения 1095,4 кДж теплоты, необходимо затратить углерода:
1095,4 кДж – х г углерода
393,51 кДж – 12 г углерода
х = 33,4 г.
5. Отсюда масса всего углерода, необходимая для получения 1280 г меди, составляет m C = 240 + 33,4 = 273,4 г.
Ответ. Для получения 1280 г меди потребуется 273,4 г углерода.
Пример 5. Исходя из теплоты образования газообразного диоксида углерода (Δ H 0 = –393,51 кДж/моль) и термохимического уравнения реакции
С (графит) + 2N2O (г) = CO2 (г) + 2N2 (г); 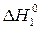 = –557,5 кДж (1)
= –557,5 кДж (1)
вычислите теплоту образования N2O(г).
Решение. Обозначив искомую величину через х, запишем термохимическое уравнение реакции образования N2O из простых веществ:
N2 (г) + 1/2О2 (г) = N2O (г);  = х кДж. (2)
= х кДж. (2)
Запишем термохимическое уравнение реакции образования CO2(г) из простых веществ:
С (графит) + O2 (г) = CO2 (г); 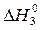 = –393,51 кДж. (3)
= –393,51 кДж. (3)
Из уравнений реакций (2) и (3) можно получить уравнение реакции (1). Для этого умножим уравнение (2) на два и вычтем найденное уравнение из уравнения (3). Имеем:
С (графит) + 2N2O (г) = CO2 (г) + 2N2 (г); (4)
 .
.
Сравнивая уравнения (1) и (4), находим: –393,51 – 2 х = –557,5. Решаем уравнение относительно х, получаем х = 82,0 кДж/моль.
Ответ. Теплота образования N2O равна 82,0 кДж/моль.
Пример 6. В каком состоянии энтропия 1 моль вещества больше:
в кристаллическом или в парообразном при той же температуре?
Решение. Энтропия есть мера неупорядоченности состояния вещества. В кристалле частицы (атомы, ионы) расположены упорядоченно
и могут находиться лишь в определенных точках пространства, а для газа таких ограничений нет. Объем 1 моля газа гораздо больше, чем объем
1 моль кристаллического вещества; возможность хаотичного движения молекул газа больше. А так как энтропию можно рассматривать как количественную меру хаотичности атомно-молекулярной структуры вещества, то энтропия 1 моля паров вещества больше энтропии его кристаллов при одинаковой температуре.
Пример 7. Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ (таблица 4 приложения) вычислите Δ G 0 реакции, протекающей по уравнению
NH3 (г) + НСl (г) = NH4Cl (т).
Может ли эта реакция при стандартных условиях протекать самопроизвольно?
Решение. Энергия Гиббса (Δ G 0) является функцией состояния и вычисляется из соотношения
∆  ∑∆ G
∑∆ G 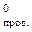 – ∑∆ G
– ∑∆ G 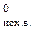 .
.
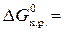 ∆ G
∆ G 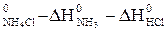 ;
;
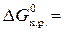 –203,22 – (–16,48) – (–95,30) = –91,44 кДж.
–203,22 – (–16,48) – (–95,30) = –91,44 кДж.
Ответ. Так как 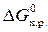 < 0, то реакция протекает самопроизвольно при стандартных условиях.
< 0, то реакция протекает самопроизвольно при стандартных условиях.
Пример 8. Реакция восстановления Fe2O3 водородом протекает по уравнению
Fe2O3 (т) + 3H2 (г) = 2Fe (т) + 3H2O (г); Δ H  = +96,61 кДж.
= +96,61 кДж.
Возможна ли эта реакция при стандартных условиях, если изменение энтропии Δ S = 0,1387 кДж/(моль∙К)? При какой температуре начнется восстановление Fe2O3?
Решение. 1. Вычисляем Δ G реакции:
 кДж.
кДж.
Так как ∆ G T,х.р > 0, то прямая реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия).
2. Найдем температуру, при которой ∆ G T,х.р = 0 (в данных условиях начинается обратимый процесс и характеризует состояние химического равновесия):
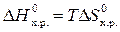 ;
;  .
.
Ответ. При температуре 695,5 К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
Пример 9. Вычислить ∆ G T,х.р реакции восстановления Fe2O3 углеродом при температуре 500 К.
Решение. 1. Запишем уравнение реакции, лежащее в основе процесса
Fe2O3 (т) + 3C (т) = 3CO (г) + 2Fe (т).
2. Энергию Гиббса при соответствующей температуре находим из соотношения ∆ G T,х.р. = ∆ H 0х.р. – T ∆ S 0х.р..
3. По закону Гесса определим тепловой эффект данного процесса
и энтропию реакции:
∆ 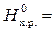 ∑∆ H
∑∆ H 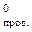 – ∑∆ Н
– ∑∆ Н  ;
;
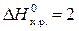 ∆ Н
∆ Н 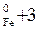 ∆ Н
∆ Н 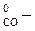 ∆ Н
∆ Н  3∆ Н
3∆ Н 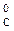 .
.
Энтальпии образования простых веществ равны нулю, т. е.
D Н 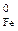 = D Н
= D Н 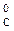 = 0.
= 0.
Энтальпии образования сложных веществ возьмем из таблицы стандартных термодинамических величин (таблица 4, приложения) и подставим:
∆ Н 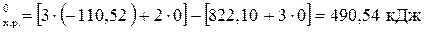 .
.
4. По закону Гесса рассчитаем энтропию данного химического процесса:
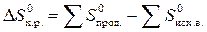
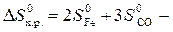 S
S  ;
;
∆  Дж/К.
Дж/К.
5. Подставим полученные значения в уравнение, не забыв привести величины к одним единицам измерения:
∆ G T,х.р. = ∆ H 0х.р. – T ∆ S 0х.р.;
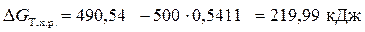 .
.
Ответ. Энергия Гиббса реакции восстановления оксида железа (III) углеродом больше нуля (∆ G T,х.р > 0), следовательно, данная реакция не может самопроизвольно протекать при 500 К.
Тепловой эффект реакции может быть выражен как в кДж, так и в ккал. Для пересчета одних единиц в другие пользуются соотношением
1 ккал = 4,18 кДж.
При решении задач данного раздела воспользуйтесь приложением 2.
***
1. Теплоты растворения сульфата меди (CuSO4) и медного купороса (CuSO4∙5H2O), равны –66,11 кДж и 11,72 кДж соответственно. Вычислите теплоту гидратации сульфата меди.
2. Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения одного моля этана (C2H6), в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании этана объемом 1 м3 (н. у.)?
3. Реакция горения бензола выражается термохимическим уравнением: C6H6 (ж) + 3,5O2 (г) = 6CO2 (г) + 3H2O (г). Вычислите тепловой эффект этой реакции.
4. Газообразный этиловый спирт можно получить при взаимодействии этилена и водяных паров. Напишите термохимическое уравнение этой реакции, вычислите ее тепловой эффект.
5. Напишите термохимическое уравнение реакции взаимодействия оксида углерода (II) и водорода, в результате которой образуются газообразные метан и вода. Сколько теплоты выделится при этой реакции, если был получен метан объемом 67,2 дм3 (н. у.)?
6. Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и HCl. Напишите термохимическое уравнение этой реакции, вычислите ее тепловой эффект. Сколько теплоты выделится, если в реакции был израсходован аммиак объемом 10 дм3 (н. у.)?
7. При сгорании газообразного аммиака образуются пары воды и оксид азота (II). Сколько теплоты выделится при этой реакции, если был получен оксид азота (II) объемом 44,8 дм3 (н. у.)?
8. Реакция горения метилового спирта выражается термохимическим уравнением
CH3OH (ж) + 1,5O2 (г) = CO2 (г) + 2H2O (ж).
Вычислите тепловой эффект этой реакции.
9. При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и газообразный сероуглерод (CS2). Напишите термохимическое уравнение этой реакции и вычислите ее тепловой эффект.
10. При взаимодействии 1 моля водорода и 1 моля селена поглотилось 77,4 кДж тепла. Вычислите энтальпию образования селеноводорода.
11. При взаимодействии 2 молей мышьяка и 3 молей водорода поглотилось 370 кДж тепла. Вычислите энтальпию образования арсина.
12. При взаимодействии 1 моля водорода и 1 моля хлора выделилось 184 кДж тепла. Вычислите энтальпию образования хлороводорода.
13. При образовании 1 моля воды из простых веществ выделилось 242 кДж тепла. Чему равна энтальпия образования воды?
14. При взаимодействии 1 моля азота и 3 молей водорода выделилось 93 кДж тепла. Чему равна энтальпия образования аммиака?
15. Вычислите, какое количество теплоты выделится при восстановлении оксида железа (III) металлическим алюминием, если при этом получилось 335,1 г железа.
16. При сжигании графита образовался диоксид углерода массой 8,86 г и выделилось 79,2 кДж тепла. Вычислите теплоту образования диоксида углерода.
17. При разложении карбоната магния на оксид магния и диоксид углерода поглощается 100,7 кДж тепла. Вычислите теплоту образования карбоната магния.
18. При сгорании жидкого этилового спирта массой 11,5 г выделилось 308,71 кДж тепла. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования C2H5OH (ж).
19. При восстановлении оксида железа (III) массой 80,0 г алюминием (реакция алюмотермии) выделяется 426,3 кДж тепла. При сгорании металлического алюминия массой 5,4 г выделяется 167,3 кДж тепла. На основании этих данных вычислите теплоту образования оксида железа (III).
20. Реакция горения аммиака выражается термохимическим уравнением:
4NH3 (г) + 3O2 (г) = 2N2 (г) + 6Н2О (ж); 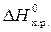 = –1530,28 кДж.
= –1530,28 кДж.
Вычислите теплоту образования аммиака.
21. При взаимодействии железа массой 6,3 г с серой выделилось 11,31 кДж тепла. Вычислите теплоту образования сульфида железа (II).
22. При сгорании ацетилена объемом 1 дм3 (н. у.) выделяется 56,053 кДж тепла. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования газообразного ацетилена.
23. Вычислите теплоту образования NO (г), исходя из следующих термохимических уравнений:
4NH3 (г) + 5O2 (г) = 4NO (г) + 6H2O (ж); 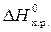 = –1168,80 кДж;
= –1168,80 кДж;
4NH3 (г) + 3O2 (г) = 2N2 (г) + 6H2O (ж); 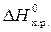 = –1530,28 кДж.
= –1530,28 кДж.
24. Вычислите теплоту образования газообразного метана, исходя из следующих термохимических уравнений:
H2 (г) + 0,5O2 (г) = H2O (ж); 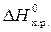 = –285,84 кДж;
= –285,84 кДж;
С (графит) + O2 (г) = CO2 (г); 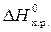 = –393,51 кДж;
= –393,51 кДж;
CH4 (г) + 2O2 (г) = 2H2O (ж) + CO2 (г); 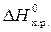 = –890,31 кДж.
= –890,31 кДж.
25. Рассчитайте 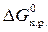 реакций:
реакций:
а) CO (г) + 0,5O2 (г) = CO2 (г);
б) 0,5N2 (г) + 1,5H2 (г) = NH3 (г);
в) C6H6 (ж) + NH3 (г) = H2 (г) + C6H5NH2 (ж).
26. При какой температуре наступит равновесие системы:
4HCl (г) + O2 (г) = 2H2O (г) + 2Сl2 (г); 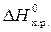 = –114,42 кДж?
= –114,42 кДж?
27. Восстановление Fe3O4 оксидом углерода идет по уравнению
Fe3O4 (т) + CO (г) = 3FeO (т) + СO2 (г).
Вычислите 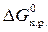 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно
и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно  в этой реакции?
в этой реакции?
28. Вычислите 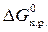 и
и  реакции горения ацетилена:
реакции горения ацетилена:
C2H2 (г) + 2,5O2 (г) = 2СO2 (г) + H2O (ж).
29. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция:
H2 (г) + CO2 (г) = CO (г) + H2O (ж); 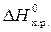 = –2,85 кДж?
= –2,85 кДж?
На основании стандартных значений 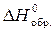 и
и 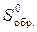 соответствующих веществ определите
соответствующих веществ определите  этой реакции.
этой реакции.
30. Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите 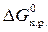 реакций, протекающих по уравнениям:
реакций, протекающих по уравнениям:
а) CS2 (г) + 3O2 (г) = CO2 (г) + 2SO2 (г);
б) Al2O3 (т) + 2Cr (т) = Сr2O3 (т) + 2Al (т);
в) CaO (т) + CO2 (г) = CaCO3 (т);
г) 2PbS (т) + 3O2 (г) = 2PbO (т) + 2SO2 (г).
31. При какой температуре наступит равновесие систем:
а) CO (г) + 2H2 (г) = CH3OH (ж); 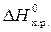 = –128,05 кДж;
= –128,05 кДж;
б) СH4 (г) + СO2 (г) = 2CO (г) + 2H2 (г); 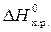 = 247,37 кДж;
= 247,37 кДж;
в) Fe3O4 (т) + CO (г) = 3FeO (т) + CO2 (г); 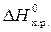 = 34,55 кДж;
= 34,55 кДж;
г) PCl5 (г) = PCl3 (г) + Сl2 (г); 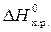 = 92,59 кДж?
= 92,59 кДж?
32. Уменьшается или увеличивается энтропия при переходах: а) воды в пар; б) графита в алмаз? Почему? Вычислите Δ S 0 для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях.
33. Не производя вычислений, укажите, для каких из перечисленных процессов изменение энтропии положительно:
а) MgO (т) + H2 (г) = Mg (т) + H2O (ж);
б) C (графит) + CO2 (г) = 2CO (г);
в) CH3COOH = CH3COO– + H+;
г) 4HCl (г) + O2 (г) = 2Cl2 (г) + 2H2O (г);
д) NH4NO3 (т) = N2O (г) + 2H2O (г).
Дайте этому объяснение.
34. При стандартных условиях теплота полного сгорания белого фосфора равна 760,1 кДж/моль, а теплота полного сгорания черного фосфора равна 722,1 кДж/моль. Чему равна теплота превращения черного фосфора в белый при стандартных условиях?
35. Этилен может перевозиться в баллонах или цистернах, а также транспортироваться по трубопроводу. Является ли процесс разложение этилена самопроизвольным?
C2H4 (г) → 2C (графит) + 2H2 (г), 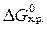 = –16 ккал.
= –16 ккал.
Идет ли разложение этилена при комнатной температуре?
36*. В процессе получения кадмия в промышленности возможно использование реакции угля с оксидом кадмия C + CdO = Cd + CO. Теплота, необходимая для осуществления процесса, обеспечивается горением углерода. Сколько потребуется углерода для получения 560 кг кадмия? Потерями углерода на побочные процессы пренебречь.
37*. Определите тепловой эффект и изменение энтропии реакции SO2 + Cl2 = SO2Cl2 (ж) при 340 К, если теплоемкости всех веществ не зависят от температуры и равны теплоемкости при 298 К. Справочные данные приведены в таблице
| Вещество | 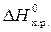 , кДж/моль , кДж/моль
| 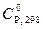 , Дж/(моль·К) , Дж/(моль·К)
|
| SO2Cl2 (ж) | –394,13 | 133,89 |
| SO2 | –296,9 | 39,87 |
| Cl2 | 33,93 |
38*. Рассчитайте стандартный электродный потенциал цинкового электрода при 25 оС, используя следующие данные.
Дата публикования: 2015-10-09; Прочитано: 5207 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
