 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Простая реакция
|
|
•Простая обратимая реакция: А = R.
Начальная концентрация компонента А - С A0, компонент R - отсутствует.
В равновесном состоянии С А,равн= c A0(1- x Р)
и С R,равн= С A0 x Р.
Из (2) получим
 ,
, 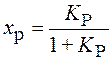 (5)
(5)
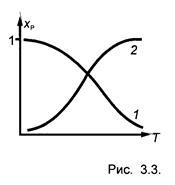
Учитывая зависимость К Р(Т) для экзо- и эндотермических реакций, можно построить зависимость x Р(Т) для этих реакций - рис. 3.3.
2. Конверсия СО с водяным паром: СО + Н2О = СО2 + Н2. Для нее
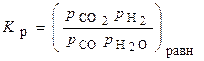
где парциальные давления компонентов p i = РС i;
Р - общее давление.
Концентрации СО, Н2О, СО2, Н2 в начальной смеси С 10, С 20, С30, С40, а в равновесии - С 1р, С 2р, С 3р, С 4р соответственно.
Выразим Сi p через равновесную степень превращения x P:
С 1р = С 10(1 - x Р); С 2р = С 20 - С 10ХР; С3р = С 30 + С 10XР; С 4р = С 40 + С 10XР;
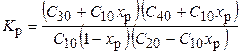
тогда из (3.39) получим квадратное уравнение относительно x P:
Его решение
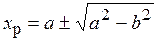
где а = КР/[2С10(КР - 1)], b = (С20/С10) [КР - С30С40/(С10С20)]. (0 < XР < 1)
3. Не всегда можно получить аналитическое выражение для xр.
Реакция SO2 + 0,5O2 = SO3 протекает с изменением объема.
Начальные концентрации SO2 и O2 - С10 и С20 соответственно.
Парциальные давления компонентов получим из определения pi = РСi
Р - общее давление.
Концентрации компонентов выразим через степень превращения SO2 - x:
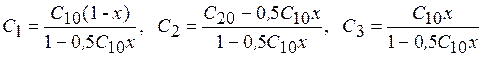
(индекс "3" относится к SO3).
В условиях равновесия
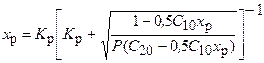
Уравнение решают методом подбора x р, после чего находят концентрации всех компонентов.
Дата публикования: 2015-10-09; Прочитано: 257 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
