 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Кинетическое уравнение
|
|
Кинетическое уравнение, или кинетическая модель, реакции - зависимость скорости реакции от условий ее протекания.
Для элементарной реакции А + B = R +..., т.е. протекающей в одну стадию, кинетическое уравнение строится на основе закона действующих масс:
r = kC A C B,(7)
где k – константа скорости реакции; C A, C B – концентрации компонентов А и В.
Закон действующих масс применим строго только к элементарной реакции, в которой взаимодействие компонентов происходит в одну стадию.
В общем виде кинетическое уравнение будем представлять в виде
r = kf (C), (8)
где f (C) – функция зависимости скорости реакции от концентраций веществ – участников реакции.
При протекании сложной реакции кинетических уравнений вида (8) будет столько, сколько частных реакций с схеме превращения.
В кинетическом уравнении (8) k - константа скорости, зависящая от температуры по уравнению Аррениуса
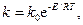 (9)
(9)
где Е - энергия активации.
Чем больше Е, тем сильнее увеличивается k с температурой.
Кинетическое уравнение вида (8) описывает скорость простой необратимой реакции (или частной реакции в сложной схеме превращения).
Простая обратимая реакция A = R есть фактически сложная реакция, в которой протекают две частные реакции: A превращается в R (прямая реакция) и R превращается в A (обратная реакция). Скорость превращения и, следовательно, скорость реакции r будет равна разности скоростей прямой r 1 и обратной r 2 реакций: r = r 1 - r 2.
Пусть обе реакции первого порядка: r 1 = k 1 C A, r 2= k 2 C R. Тогда
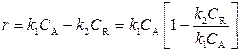 |
В преобразованном уравнении перед квадратной скобкой стоит выражение скорости прямой реакции.
В равновесии концентрации компонентов А и R будут, естественно, равновесными, равными CA.равн и CR,равн, и r = 0. Это возможно, если выражение в квадратных скобках равно нулю, т.е. CR.равн/CA.равн = k1/k2.
Термодинамическое условие равновесия устанавливает связь К P = (C R/ C A)равн. Из последних двух уравнений следует связь кинетических (k 1, k 2) и термодинамического (К P) параметров:
k 1/ k 2 = К P (10)
Зависимости k 1, k 2, К P от температуры имеют вид
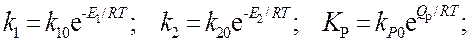 |
Подставив k 1 и k 2 в (10), получим
Q P = E 2 - E 1, (11)
т.е. тепловой эффект обратимой реакции равен разности энергий активации обратной и прямой реакций. Это соотношение следует из рассмотрения диаграммы "путь реакции - потенциал реагирующей системы" (рис. 2).
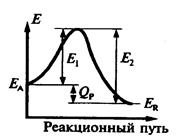
На диаграмме ЕA и ЕR потенциалы исходного вещества А и продукта R. Разность их QP высвобожденная энергия в результате превращения. Для превращения А в R необходимо преодолеть энергетический барьер величиной Е 1 (энергия активации прямой реакции). В обратном направлении - величина такого барьера Е 2. Разность между ними и дает величину теплового эффекта Q P.
Для экзотермической реакции Q P > 0 и Е 2 > Е 1 (как показано на рис. 2). Для эндотермической Q P < 0 и Е 2< Е 1.
Скорость любой обратимой реакции всегда можно представить так:
 |
(12)
где r 1 - скорость реакции в прямом направлении; - выражение закона действующих масс как в уравнении равновесия (12), но концентрации текущие, а не равновесные.
Дата публикования: 2015-10-09; Прочитано: 880 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
