 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Базисная система стехиометрических уравнений
|
|
Базисная система стехиометрических уравнений, однозначно и полно описывающая процесс, должна содержать число стехиометрически независимых уравнений, определяемых уравнениями:
Для реакции обмена:
У = В – (Э – 1),где У – число уравнений в базисной системе, В-число веществ, Э-число элементов, из которых состоят вещества
Для ОВР:
У = В – Э (соблюдается не только поэлементный баланс, но и баланс по электронам)
Степень превращения -отношение количества превращенного исходного вещества N 0 – N к его начальному количеству N 0.
Степень превращения может быть определена для любого исходного реагента, например, x А = (N А0 – N А)/ N А0, x В = (N В0 - N В)/ N В0.
Связь между степенями превращения двух исходных веществ:
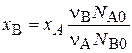
Степень превращения
Количество любого вещества Ni в реагирующей смеси можно определить по формуле:
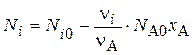
В сложной реакции полнота превращения определяется для каждого стехиометрического уравнения. Определив x A j - его степень превращения в каждом j -ом уравнении, можно рассчитать количество Ni любого компонента:
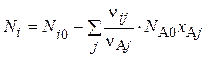
Стехиометрия в технологических расчетах
Концентрации компонентов в реакционной смеси.
И стехиометрические уравнения, и степень превращения определяют изменение количества вещества. На практике состав смеси выражают через концентрации компонентов:
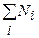
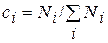
Общее количество реагирующей смеси

Стехиометрия в технологических расчетах
Величина - изменение числа молей в реакции, по ней судим об изменении объема.
Начальные концентрации
 , то
, то 
Выход продукта - это отношение количества исходного вещества например А, к количеству А, превратившегося в продукт.
Для продукта R: ЕR= nА(NR – NR0)/ NА0*nА
Для простой реакции: ЕR=ХА
Для сложной реакции вводится понятие селективности – показывает, какая доля превратившегося исходного вещества пошла на образование заданного.

ER и SR имеют значение для сложных реакций,
для простых SR =1., ER= XA
Интегральная селективность по продукту – это отношение количества исходного вещества, превращенного в данный продукт, ко всему количеству превращенного реагента.
Интегральная селективность по продукту R (при NR0 = 0)
SR = nА1 *NR /nR(NА0 - NА)
Для двух последовательных реакций:
nАA  nRR
nRR  nSS
nSS
Интегральная селективность по продукту R (при NR0 = 0)
SR = nА *NR /nR(NА0 - NА)
Термодинамические закономерности.
Химическое равновесие определяется условием D GP,T = 0.
Уравнение Вант-Гоффа (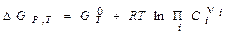 ) определяет зависимость энергии Гиббса D GP,T от состава реакционной смеси.
) определяет зависимость энергии Гиббса D GP,T от состава реакционной смеси.
Назовем равновесными состав смеси и концентрации компонентов при химическом равновесии, и тогда:
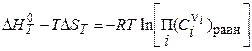
Выражение в квадратных скобках определяет константу равновесия химического превращения КР, представленного стехиометрическим уравнением:
(1) 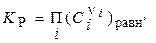 и
и
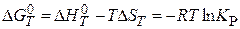
т.е. константа равновесия K p - термодинамическая функция, зависящая только от температуры:
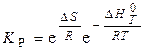 (0)
(0)
Отметим, что концентрации в уравнении (1) определены относительно стандартного состояния, т.е. они безразмерные. Соответственно, K p – также безразмерная величина. На практике используют концентрации веществ разной размерности, соответственно, равновесный состав смеси, определяют из уравнений:
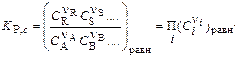 (2) или
(2) или 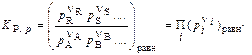 (3)
(3)
где Ci и pi – соответственно равновесные концентрации и парциальные давления компонентов; nA, nB, nR, nS, - стехиометрические коэффициенты. ni - стехиометрические коэффициенты в уравнении реакции в алгебраической форме.
Для неидеальной смеси в (2) используют активности вместо концентраций, а в (3) - летучести вместо парциальных давлений.
Если реакционная смесь идеальна (небольшие температуры и давления, разбавленные растворы), то, используя справочные значения или и D ST, можно рассчитать K P из (0).
Многие реальные смеси являются не идеальными, и для них используют формулы расчета K P в таком виде:
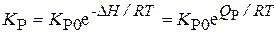
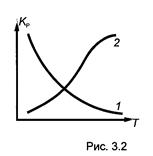
K P будет увеличиваться с ростом температуры для эндотермических реакций (Q P < 0) и уменьшаться для экзотермических (Q P > 0)
Если какой-то компонент в реагирующей системе находится в твердом состоянии, то его концентрация тем самым фиксирована. Эту постоянную величину обычно включают в константу равновесия. В таком случае в выражение, например, (3) войдут равновесные парциальные давления только газообразных компонентов.
Для упомянутой выше реакции сажеобразования
СО + Н2 = Ств + Н2О
углерод (сажа) Ств образуется в твердом состоянии, и
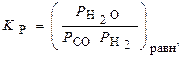
Дата публикования: 2015-10-09; Прочитано: 625 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
