 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химические процессы
|
|
Химический процесс – явление взаимодействия химической реакции и процессов переноса на молекулярном уровне, которые являются его составляющими.
Группа А (по ф/х признакам, характеризующих протекающую реакцию)
Группа Б (физические признаки, характеризующие фазовый состав с реагентом)
Группа А:
- тип химической реакции:
- прямое химическое взаимодействие
- реакция с химическим воздействием (каталитическая реакция)
- реакция с физическим воздействием (под действием света, радиационная реакция, электрохимическая реакция)
- термодинамические показатели:
а) тепловой эффект:
· экзотермический процесс
· эндотермический процесс
· смешанный ХП
б) направленность превращения:
· обратимые ХП (до Хр)
· необратимые (нет равновесия, не достигается)
· смешанные ХП
- кинетические характеристики:
а) схема превращения
· простая реакция
· сложная (параллельная, последовательная)
· общий случай
б) кинетическая модель
r = f (С, T)
Группа Б
1.фазовый состав:
а) число участвующих фаз с реагентами:
· гомогенный ХП (все реагенты в одной фазе)
· Гетерогенный (многофазный)
- состояние фаз
а) газ
б) жидкость
в) твердое
основная цель изучения ХП изучение скорости превращения в нем и влияния на ХП условий протекания.
Гомогенный ХП – процесс протекающий в одной фазе. В этой фазе выровнены все условия протекания реакции во всем выделявшемся объеме.
- простоя реакция
а) необратимая
Гетерогенный химически процесс – процесс, в котором исходные вещества и в общем случае продолжают находится в разных фазах.
Аг + Втв = Rг + S
Гетерогенные процессы подразделяют:
- «газ - твердое»
а) адсорбция
б) десорбция
в) обжиг руды
г) окисление Ме
д) горение тв. топлива
- «газ - жид»
а) адсорбция
б) десорбция
в) дистилляция
г) ректификация (протекает с химическим взаимодействием)
- «жид - тв»
а) адсорбция
б) десорбция
в) кристаллизация
г) растворение
д) выщелачивание
- «жид - жид» (несмачивающие)
а) экстракция
б) эмульгирование
- «тв - тв»
а) процесс спекания (производство цемента)
б) высокотемпературный синтез неорг материала
- многофазная система.
В гетерогенных ХП реактанты находятся в разных фазах, а реакция протекает либо на границе раздела фаз, либо в одной из фаз.
1. «Газ – тв» («жид - тв»)
Aг + Bт = Rг (модель «сжимающаяся сфера»)
происходит уменьшение размера твердого материала по мере протекания процесса вплоть до его исчезновения
структура процесса:
В газовой фазе:
- I Перенос реагента А из газового потока к поверхности твердой частицы
- II Реакция А с твердым В на наружной поверхности частицы
- Перенос продукта реакции R от поверхности в газовый поток
В твердой фазе:
- II Реакция В с газообразным компонентом А поверхности
- Изменение (уменьшение) размера частицы r

Допущения:
- тв частица – шарообразной формы.
- поверхность частицы тв. – равнодоступна, т.е. перенос между потоком и частицей, одинаков по всей поверхности.
- Тпотока = Тчастицы
По мере протекания процесса происходит уменьшение размера тв материала, вплоть до его исчезновения. (размер = 0, реакция прошла до конца).
Математическая модель:
WI = WII
WI = -bSr(C0 - CП)
WII = -k(CП)Sr, где: b - коэффициент массообмена, k - константа скорости реакции, Sr – поверхность твердой частицы, tк - время полного превращения, C0 - концентрация А в потоке, R0 - первонач. радиус частицы, CП - концентрация А на поверхности, r - радиус частицы.
Наблюдаемая скорость:
Wн=-kCп=-kC0/(1+k/b)=Kн*C0
Наблюдаемая скорость превращения, отнесенная к одной частице:
Wн(част)= WнSr= Wн*4pr2= - 4pR02КНC0r2= -4pR02КНC0(1 - t/tк)2

Изменение во времени t безразмерного радиуса частицы r (а), степени превращения твердого реагента x В (б) и скорости превращения частицы W н(част) (в) для гетерогенного процесса "сжимающаяся сфера". t к - время полного превращения.
r = 1 - t / t к;
х B = 1 - (1 - t / t к)1/3;
Wн(част) = -4pR02КНC0(1 - t/tк)2
Лимитирующие стадии и режимы процесса
· Если k<<b, т.е. реакция малоинтенсивна; CП~ C0, Wн=-kС0 кинетический режим: Химическая реакция – лимитирующая стадия
· Если k>>b, интенсивность массообмена мала; CП<< C0, Wн=-b С0 диффузионный режим: массоперенос – лимитирующая стадия
 Влияние условий процесса на скорость превращения
Влияние условий процесса на скорость превращения
Влияние температуры
Зависимость наблюдаемой константы КН скорости превращения в гетерогенном процессе "сжимающаяся сфера" от температуры Т. Пунктир – k(T).
Режимы процесса:
1 – кинетический (k<<b, Kн=k);
2 - переходный;
3 – диффузионный (k>>b, Kн=b
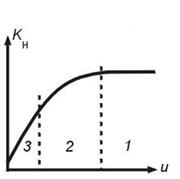
Влияние скорости газового потока
Зависимость скорости обтекания частицы u от температуры Т.
Режимы процесса:
1 – кинетический (при больших скоростях потока с возрастанием b режим не зависит от u);
2 - переходный;
3 – диффузионный
(b << k, Kн=b и увеличивается с увеличением скорости газового потока).
Дата публикования: 2015-10-09; Прочитано: 337 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
