 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Приклади розв’язання задач. Приклад 1. Водний розчин містить 5% сечовини [(NH2)2CO] і 10% глюкози (С6Н12О6)
|
|
Приклад 1. Водний розчин містить 5% сечовини [(NH2)2CO] і 10% глюкози (С6Н12О6). Яка температура замерзання цього розчину, якщо кріоскопічна константа для води дорівнює 1,86?
Розв’язок. Знайдемо моляльні концентрації водних розчинів сечовини та глюкози: mсечовини =  ;
;
mглюкози =  .
.
За рівнянням ΔТз = Ккm розрахуємо зниження температури замерзання водних розчинів:
ΔТз(сечовини) = 1,86∙0,877 = 1,6310;
ΔТз(глюкози) = 1,86∙0,617 = 1,1480.
Загальне зниження температури замерзання розчину складе 2,7790, а температура замерзання буде -2,7790С.
Приклад 2. Визначте температуру кипіння водного розчину, що містить 0,015 моль нелеткої розчиненої речовини в 400 г води, якщо питома теплота випаровування води при температурі кипіння дорівнює 2,464•103 Дж/кг.
Розв’язок. Підвищення температури кипіння розчину знаходимо за рівнянням: ΔТк = Кеm, попередньо визначивши Ке за рівнянням:
Ке = RT2к/1000∙ l;  Ке = 0,513.
Ке = 0,513.
Моляльна концентрація розчину складе: m = 0,015∙2,5 = 0,0375 моль/кг. Отже, ΔТк = 0.513∙0,0375 = 0,0190. Температура кипіння розчину
Т = 100 + 0,019 = 100,0190С.
Приклад 3. Розчин 0.22 г фенолу в 250 г циклогексану замерзає на 0.095 градуса нижче за температуру замерзання індивідуального розчинника. Визначити молекулярний стан фенолу в циклогексановому розчині.
Розв'язок. Молярна маса фенолу дорівнює 94 г/моль. Таким чином, 0.22г цієї речовини складають 0.22/94=0.00234 моля, які розчинені за умовою в 250г розчинника. Отже, в 1000 г циклогексану розчинено 0.00234×4=0.00936моля. Якби фенол знаходився в розчині в мономерній формі, то, враховуючи його кріоскопічну константу (20.2), його температура замерзання становила б DTз=Ккm=20.2×0.00936=0.1890. Оскільки експериментальне зниження температури замерзання приблизно вдвічі менше, то це означає, що число молекул в розчині вдвічі менше у порівнянні із тим, яке було б, якщо молекули фенолу в циклогексані були б мономерними. Таким чином, фенол у розчині знаходиться у вигляді димеру (С6Н5ОН)2.
Приклад 4. Розрахувати розчинність кисню повітря у воді за стандартних умов. Константа Генрі для кисню дорівнює 4.4×109 Па.
Розв'язок. Парціальний тиск кисню в повітрі дорівнює 1.013×105×0.21=2.13×104 Па (об'ємна частка кисню в повітрі дорівнює 0.21, а оскільки для газів об'ємна та молярна частки співпадають, то для знаходження парціального тиску кисню треба атмосферний тиск помножити на молярну частку кисню). Оскільки, N=p/К, знаходимо: 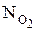 =2.13×104/4.4×109=4.83×10-6.
=2.13×104/4.4×109=4.83×10-6.
Приклад 5. Змішали речовини А і В у мольному співвідношенні 0,2:0,3 при 200С. Розрахувати зміну ентропії та зміну енергії Гіббса, якщо відомо, що речовини А і В утворюють доскональний розчин.
Розв’язок. ΔS знайдемо за рівнянням:
ΔS = -R(n1lnN1 + n2lnN2 + n3lnN3 + ….+nilnNi)
ΔS = -8,314[0,2ln(0,2/0,5) + 0,3ln(0,3/0,5)] = 2,79 Дж/(моль∙К)
Зміна енергії Гіббса при утворенні досконального розчину розрахуємо за рівнянням:
ΔG = RT(n1lnN1 + n2lnN2 + n3lnN3 + ….+nilnNi)
ΔG = 8,314∙293,15[0,2ln(0,2/0,5)+0,3ln(0,3/0,5)]= -820,15 Дж/моль.
Приклад 6. При збільшенні температури на 20 тиск пари амізолу змінюється від атмосферного (Ткип.= 153,70С) до 106650 Па. Розрахуйте молярну теплоту випаровування амізолу.
Розв’язок. Використовуємо рівняння Клаузіуса-Клапейрона
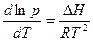
При інтегруванні у вузькому інтервалі температур ∆Н можна вважати сталою, і тоді одержимо:
 ; після підстановки даних отримуємо ∆Н = 38,97 кДж/моль.
; після підстановки даних отримуємо ∆Н = 38,97 кДж/моль.
Приклад 7. Тетрахлорид вуглецю та трихлорметан утворюють розчин, який можна вважати ідеальним. При 353 К тиск насиченої пари ССl4 дорівнює 81.9 кПа, а тиск насиченої пари CHCl3 дорівнює 137.3 кПа. Який склад буде мати суміш цих рідин, якщо вона кипить при температурі 353 К? Який буде склад пари, що при цьому утворюється?
Розв'язок. Потрібно розрахувати склад суміші, у якій при 343 К загальний тиск насиченої пари дорівнюватиме атмосферному, тобто 101.32кПа. Оскільки загальний тиск пари
р = 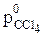
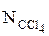 +
+ 
 =
= 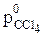
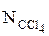 +
+  (1-
(1- 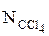 ),
),
то молярна частка тетрахлориду вуглецю у суміші дорівнює:
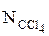 =(p-
=(p-  )/(
)/(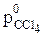 -
-  )=(101.32-137.3)/(81.9-137.3)=0.65,
)=(101.32-137.3)/(81.9-137.3)=0.65,
а  = 1-0.65 = 0.35
= 1-0.65 = 0.35
Склад пари, що утворюється при кипінні при температурі 353 К, дорівнює:  /
/ 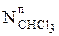 = (
= ( /
/  )×(
)×(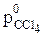 /
/  ) =
) =
= (0.65/0.35)× (81.9/137.3) = 1.11.
Звідси  =1.11/(1.11+1) = 0.52,
=1.11/(1.11+1) = 0.52, 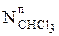 =1- 0.52=0.48.
=1- 0.52=0.48.
Як бачимо, у порівнянні із складом рідини, склад пари збагатився більш легколетким компонентом - трихлоридом карбону.
Приклад 8. Визначте тиск насиченої пари розчинника над розчином (при 250С), який вміщує 0,08 моль нелеткої біологічно активної речовини (неелектроліту) у 100 г води. Тиск насиченої пари води при 250С дорівнює 3,167 кПа. Відповідь: 3,122 кПа.
Розв'язок. Розрахуємо мольну частку розчиненої речовини:
N2 = n1/(n1 + n2); кількість моль води складе n2 = 100/18 = 5,56 моль.
N2 = 0,08/(0,08 + 5,56) = 0,0142.
Використовуючи перший закон Рауля
N2 = (p0 – p)/p0
знаходимо тиск насиченої пари розчинника над розчином р = 3,122 кПа.
Дата публикования: 2015-09-18; Прочитано: 3109 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
