 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Тема 5 РОЗЧИНИ
|
|
Ідеальні і реальні розчини. Закон Рауля. Колігативні властивості розбавлених розчинів.
Література: [1]ст.197-200, [4]ст.109-113
Розчин - це гомогенна однофазна система, кожен елемент об'єму якої має однаковий хімічний склад та однакові термодинамічні властивості. Утворення розчину - процес завжди самочинний, тобто за ізобарно-ізотермічних умов утворення розчину супроводжується зменшенням енергії Гіббса системи.
Основними параметрами стану розчинів є: тиск, температура та концентрація, тобто відносна кількість компонентів. Склад розчину можна виражати у: масових відсотках, молярних відсотках, молярних частках, в молях розчиненої речовини на 1 кг розчинника (моляльність), в молях розчиненої речовини на 1 л розчину (молярність).
Нескінченно розведеними називаються розчини, в яких молярна частка розчинника наближається до 1, а молярні частки розчинених речовин до 0. Залежність тиску пари розчиненої речовини від його концентрації в розчині виражається законом Генрі:
р = Г∙с,
де Г – константа Генрі, яка залежить від температури, природи компонентів розчину та способу вираження його складу; с – молярна концентрація.
Якщо молярну концентрацію замінити на молярну частку, то рівняння буде мати вигляд:
р = Г1∙N,
але і Г1 буде відрізнятися від Г.
Якщо ідеальний розчин знаходиться у рівновазі із парою над цим розчином, то це означає рівність хімічних потенціалів кожного із компонентів розчину у рідкій фазі та у парі, тобто mі(п)=mі(рід). Оскільки
m(п)= m°(п)+RTlnp, a m(рід)=m°(pід)+RTlnN(рід),
де N(рід) - молярна частка рідкого компоненту розчину у рідкій фазі. Звідси випливає, що
m°(п)+RTlnp =m°(pід) +RTlnN(рід).
Диференціюючи це рівняння та беручи до уваги те, що m°(п) та m°(pід) - константи, одержуємо:
dlnp=dlnN
Позначимо тиск насиченої пари над індивідуальною рідиною через р°, а тиск насиченої пари над розчином - р. Тоді, одержуємо:
ln(p/p°) = ln(N/1), або р=р°N(рід)
Це рівняння є математичною формою закону Рауля, згідно з яким тиск насиченої пари над розчином дорівнює тиску насиченої пари над індивідуальним розчинником, помноженому на молярну частку розчинника у розчині.
Склад розчину зв'язаний із хімічними потенціалами компонентів рівнянням Гіббса-Дюгема:
NAdmA + NBdmB = 0
можна одержати іншу форму рівняння Гіббса-Дюгема:
NAdlnpA + NBdlnpB = 0
Останнє рівняння зв'язує парціальні тиски пари компонентів над рідким розчином із складом рідкої фази.
Температура кипіння розведеного розчину, що містить нелетку розчинену речовину, вище температури кипіння розчинника. Підвищення температури кипіння пропорційно моляльній концентрації розчиненої речовини
∆Ткип. = Кеm,
де Ке – ебуліоскопічна стала, яказалежить тільки від природи розчинника і може бути визначена за формулою:
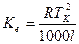 ,
,
де Тк – температура кипіння розчинника, l – питома теплота випаровування розчинника.
Молекулярна маса розчиненої речовини пов’язана з підвищенням температури кипіння рівнянням:
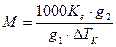 ,
,
де М – молекулярна маса розччиненої речовини, g1 – маса розчинника, g2 – маса розчиненої речовини.
Якщо розчинник та розчинена речовина не утворюють твердого розчину, та температура замерзання розчину нижча за температуру замерзання розчинника. Для зниження температури замерзання розчину справедливі співвідношення:
∆Ткип. = Ккm,
ке Кк – кріоскопічна стала.
 ,
,
де ТЗ – температура замерзання розчинника, r – питома теплота плавлення розчинника.
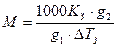 ,
,
Осмотичний тиск розчину дорівнює тиску, який потрібно прикласти до розчину ззовні, щоб підняти тиск його пари до тиску пари чистого розчинника. Осмотичний тиск розчину пропорційний молярній концентрації розчиненої речовини
π = c∙R∙T,
де с – молярна концентрація розчиненої речовини.
Доскональним називається розчин, який утворений компонентами, що мають близькі властивості. Доскональні розчини утворюються без зміни тепловмісту та об’єму системи.
Зміна ентропії та енергії Гіббса при утворенні досконального розчину виражається рівняннями:
DНзм. = 0
ΔSзм. = -R(n1lnN1 + n2lnN2 + n3lnN3 + ….+nilnNi)
ΔGзм. = RT(n1lnN1 + n2lnN2 + n3lnN3 + ….+nilnNi).
Всі компоненти досконального розчину підпорядковуються закону Рауля. Склад пари над доскональним розчином відрізняється від складу розчину: у пар переходить у надлишку той компонент, при додаванні якого до розчину підвищується загальний тиск пари. Залежність між складом двохкомпонентного розчину та складом пари виражається рівнянням:
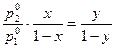 ,
,
де x – молярна частка другого компоненту в розчині; y – молярна частка другого компоненту у парі.
Реальні гази тим більше відхиляються від ідеальності, чим вищий їх тиск (чи, що в даному випадку те ж саме, чим більша їх концентрація). Для того, щоб мати змогу при розрахунку властивостей реальних газів користуватись рівняннями, виведеними для ідеальних газів, тиск в цих рівняннях замінюють на величину, яка одержала назву леткість, або фугітивність. Фугітивність має розмірність тиску і зв'язана з тиском співвідношенням:
F = gp,
де g - коефіцієнт леткості (фугітивності).
Всі закони ідеальних газів, про які йшлося вище, поширюються на реальні системи, якщо замість тиску підставляти леткість. Так, наприклад, рівняння Менделєєва-Клапейрона для реальних газів може бути записано у формі fv=nRT, або gpv=nRT. Рівняння для константи рівноваги записується у формі  , або
, або 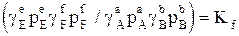 .
.
Гранично розведеним називається розчин, у якому концентрація розчиненої речовини нескінченно мала. У таких розчинах розчинник підпорядковується законам ідеальних розчинів, а розчинена речовина не підпорядковується. Тому в гранично розведених розчинах для розчинника можна користуватися всіма рівняннями, що справедливі для ідеальних розчинів.
Неідеальними розчинами називаються всі розчини, що не підпорядковуються термодинамічним закономірностям ідеальних і гранично розведених розчинів. Серед неідеальних розчинів виділяють регулярні та атермальні розчини. Регулярні - це реальні розчини, у яких при змішуванні компонентів, взятих в однаковому агрегатному стані, зміна ентальпії й об’єму не дорівнює нулю, але зміна ентропії така ж, як при змішуванні ідеальних газів. Такими властивостями володіють розчини неполярних неассоційованих рідин. Атермальні розчини - це реальні розчини, теплота утворення яких дорівнює нулю. Це характерно для ідеальних розчинів, у зв'язку з чим їх можна розглядати як ідеальні по своїх енергетичних властивостях. Близькі до атермальних багато розчинів високомолекулярних речовин у звичайних низькомолекулярних розчинниках.
Дата публикования: 2015-09-18; Прочитано: 2386 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
