 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Діаграми стану
|
|
Хімічний потенціал. Термодинаміка розчинів (загальні поняття). Способи вираження концентрації двокомпонентних систем. Фазові рівноваги. Правило фаз. Діаграми стану однокомпонентних систем. Рівняння Клаузіуса-Клапейрона. Двокомпонентні системи. Метод термічного аналізу. Побудова діаграм плавлення. Рівновага тверда фаза - рідина у системах, компоненти яких нерозчинні один в одному у твердій фазі, компоненти яких обмежено розчинні один в одному у твердій фазі. Рівновага рідина -пара в бінарних системах. Закони Коновалова. Ректифікація. Взаємна розчинність рідин. Обмежена розчинність рідин. Трикомпонентні системи. Розподіл речовин між двома рідкими фазами. Закон розподілу.
Література: [1]ст.100-102, 182-190, [4] ст.52-54, 76-77, [1]ст.153-158, [4]ст.66-73, [1]ст.165-176, [4]ст.120-132, [1]ст.211-222, [4]ст.94-106
Фазою (f) називається сукупність тілесних об’єктів, що мають певний хімічний склад і термодинамічні властивості, відділені від інших фаз поверхнею розділу.
Числом компонентів (К) називається число індивідуальних речовин, що входять в систему, мінус число хімічних рівнянь, які зв’язують ці речовини.
Числом ступенів свободи (С) називається число параметрів (Т, Р, концентрації), які повністю визначають стан системи при рівновазі, або, іншими словами, число параметрів, які можна змінювати в певних межах без зміни сисла і природи фаз.
Для однокомпонентних систем правило фаз Гіббса має вигляд С=К+2-f (2 відповідає кількості незалежно змінних параметрів – температурі і тиску).
Для великого числа практично важливих випадків тиск є постійним. Для таких випадків правило фаз виражається рівнянням С=К+1-f. Останнє співвідношення застосовується для розрахунку кількості ступенів свободи в двокомпонентних системах.
Приклад 1. Визначити числоступенівсвободи при затвердненні розплавлених: 1) чистого олова; 2) сплаву олова і свинцю, що утворює кристали свинцю; 3) сплаву олова і свинцю, що утворює кристали олова і свинцю.
Розв’язок. Зміна тиску майже не впливає на температуру плавлення чистих металів і сплавів. Тому для такої системи газову фазу до уваги не беруть, а враховують тільки один зовнішній фактор – температуру. Тому число ступенів свободи обчислюють за рівнянням С=К+1-f.
1) Охолодження розплавленого олова викликає утворення твердої фази – кристалів олова. Настає рівновага однокомпонентної системи між рідкою і твердою фазами. Число ступенів свободи для такої системи: С=1+1-2=0.
Система стає нонваріантною. Тому температура кристалізації набуває суворо певного значення і не змінюється поки відбувається кристалізація олова.
До початку кристалізації і після повного затверднення всієї маси рідкого олова число фаз системи дорівнює 1, система моноваріантна і має один ступінь свободи (температуру можна змінювати в певних межах, не змінюючи агрегатного стану олова).
2) В момент кристалізації свинцю з розплаву свинець – олово система складається з двох фаз: рідкої (розплав свинець – олово) і твердої (кристали свинцю). Число ступенів свободи такої двокомпонентної системи: С=2+1-2=1.
Система моноваріантна, тобто кристалізація свинцю з розплаву відбувається із зміною температури.
3) В момент кристалізації одночасно свинцю і олова з розплаву свинець – олово система складається з трьох фаз: рідкої (розплав свинець – олово) і двох твердих (кристали олова і свинцю). Число ступенів свободи такої двокомпонентної системи: С=2+1-3=0.
Одже, система нонваріантна, і затверднення відбувається при точно певній температурі і складу системи.
Термічний аналіз грунтується на вивченні залежності температури плавлення системи від її складу. У цьому методі результати дослідження подають графічно у вигляді діаграми температура плавлення – склад.
Користуючись діаграмою стану (плавкості) системи, можна визначити залежність температури плавлення сплаву від його складу, характер взаємодії компонентів системи, наявність утворення сполук з компонентів, структуру сплаву, а також можна підібрати склад сплаву з потрібними властивостями і передбачити правильний режим технологічного процесу приготування сплаву.
На рисунку 1 подано криві охолодження свинцю, стибію і їх сумішей.
При охолодженні розплавленого свинцю до 328° С температура рівномірно знижується через певні проміжки часу (ділянка аb на кривій 7). У точці b при 328° С починається кристалізація свинцю з виділенням тепла. Зниження температури припиняється, бо виділена теплота затверднення компенсує її відведення. Тому на кривій охолодження 1 утворюється горизонтальна ділянка bс.
Коли зникне остання краплина розплавленого свинцю (точка с на кривій 2), температура знову почне рівномірно спадати, оскільки з цього моменту втрата тепла в навколишнє середовище вже нічим не компенсується (ділянка cd на кривій 1).
Аналогічну криву охолодження має чистий стибій; ділянка bс на кривій b відповідає температурі кристалізації стибію 631°С.

Рисунок 1 – Криві охолодження свинцю, стибію і їх сумішей
1 – 100% Pb, 2 – 10% Sb, 90% Pb, 3 – 13% Sb, 87% Pb, 4 – 40% Sb, 60% Pb,
5 – 60% Sb, 40% Pb, 6 – 100% Sb
При охолодженні рідкого сплаву, що містить 10% стибію і 90% свинцю, відбувається рівномірне зниження температури до 260°С (ділянка аb на кривій 2). При температурі, нижчій за 260°С, починається кристалізація свинцю з виділенням тепла, що зумовлює менш різке зниження температури, бо теплота кристалізації частково компенсує втрату тепла в навколишнє середовище (ділянка bс на кривій 2).
У точці с (крива 2) при 247°С відбувається сумісна кристалізація свинцю і стибію з утворенням так званої евтектичної суміші (евтектики). Утворення евтектики супроводиться виділенням тепла, температура системи залишається сталою до повного затвердівання сплаву (ділянка cd на кривій 2). Охолодження твердого сплаву, що складається з евтектики (суміші дрібних кристаликів свинцю і стибію) і крупних кристалів свинцю, супроводиться рівномірним спадом температури (ділянка dk на кривій 2).
При охолодженні розплаву, склад якого відповідає складу евтектики (13 % стибію і 87 % свинцю), температура рівномірно знижується до початку утворення твердої евтектики (ділянка ас на кривій 3), а потім зниження температури припиняється (ділянка cd), поки розплавне затвердне; охоло-дження твердої евтектики супроводиться рівномірним зниженням температури (ділянка dk).
При охолодженні розплаву, що складається з 40% стибію і 60 % свинцю, спочатку кристалізується стибій при 425°С (ділянка bс на кривій 4), а потім утворюється тверда евтектика при 247°С (ділянка cd). Для рідкого сплаву, що складається з 60 % стибію і 40% свинцю, крива охолодження (крива 5) аналогічна до кривої 4, алекристалізація стибію починається при вищій температурі (525°С – точка b на кривій 5).
За кривими охолодження 1 і 6 визначають температуру кристалізації свинцю і стибію, а за кривими охолодження 2, 4 і 5 – температуру початку кристалізації різних сплавів цих металів і температуру кристалізації евтектики.
На основі знайдених результатів будують діаграму плавкості системи свинець – стибій, відкладаючи на осі абсцис склад сумішей у масових процентах, а на осі ординат – температуру початку кристалізації свинцю і стибію з розплаву сумішей. Знайдені точки сполучають плавною лінією (рис. 2).
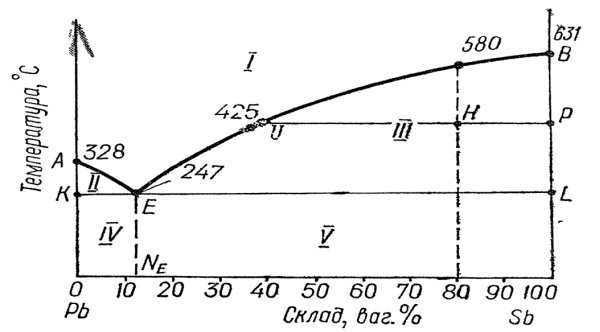
Рисунок 2 – Діаграма плавкості системи свинець – стибій
1– розплав; 2 – розплав і кристали свинцю; 3 – розплав і кристали стибію;
4 – евтектика і кристали свинцю; 5- евтектика і кристали стибію.
Температури кристалізації чистих свинцю і стибію знаходяться в точках А і В.
Крива, що відповідає температурам початку кристалізації, називається лінією ліквідуса (тобто рідини), або просто ліквідусом. Залежності температури кристалізації стибію і свинцю від складу сплаву позначені лініями ліквідуса відповідно ВЕ і АЕ.
Точка Е, що сполучає лінії ліквідуса АЕ і ВЕ, називається евтектичною точкою; вона визначає температуру затвердівання евтектики K і склад евтектики NE.
Лінія КEL, що відповідає температурі кінця рівноважної кристалізації (повного затвердівання) розплаву різного складу, називається лінією солідусу (тобто твердого тіла), або просто солідусом.
Крива А Е показує рівновагу між кристалами свинцю і розплавом різного складу, а крива ВЕ – рівновагу між кристалами стибію і розплавом різного складу.
Евтектична точка Е відповідає рівновазі між розплавом і затверділою евтектикою з двома кристалічними фазами (дрібні кристали свинцю і стибію). Така рівновага називається евтектичною рівновагою.
Вище від ліквідуса АЕВ система свинець – стибій перебуває в рідкому стані, а нижче від солідуса КЕL – у твердому. На ділянці, що лежить між лінією ліквідуса АЕ і лінією солідуса КЕ, міститься двофазна система, що складається з розплаву свинцю і стибію та кристалів свинцю, а на ділянці між лінією ліквідуса ВЕ і лінією солідуса LE – двофазна система, що складається з розплаву свинцю та стибію і кристалів стибію.
Приклад 2. Користуючись правилом важеля, за діаграмою плавкості системи свинець – стибій визначити: 1) склад евтектичної суміші; 2) скільки стибію виділиться, якщо 20 кг рідкого сплаву, що містить 80 % стибію, охолодити до 425° С.
Розв'язок. 1) Перетин перпендикуляра, опущеного з точки Е, з віссю абсцис, дає нам точку NE, яка відповідає евтектичній суміші, що складається з 13% Sb і 87% Рb.
2) При охолодженні рідкого сплаву, що містить 80 % Sb, перші кристали стибію утворюються при 580° С. У міру випадання кристалів стибію процентний вміст свинцю в розплаві підвищується до 60 %.
При охолодженні 20 кг розплаву до 425° С викристалізовується mSb кг стибію. Тоді маса розплаву в точці U буде:
mрід.=m – mSb.
Абсолютна кількість свинцю в розплаві при охолодженні не змінюється, але оскільки частина стибію виділиться з розплаву у вигляді кристалів, то процентний вміст свинцю підвищиться від 20 до 60% (рис. 2).
Співвідношення між кількістю твердої і рідкої фаз визначаємо за правилом важеля (рис. 2)
mSbтв./ mрід. = UH/HP = 40/20=2
mрід. при 4250С = 20- mSbтв.
mSbтв./ 20- mSbтв.=2, звідки mSbтв.=13,33 кг.
Дата публикования: 2015-09-18; Прочитано: 1942 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
