 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Методы определения коэффициента селективности
|
|
Коэффициент селективности электрода можно определить с помощью метода отдельных растворов и метода постоянного вещества.
В первом методе измеряется разность потенциалов между мембранным электродом и электродом сравнения в каждом из двух отдельных растворов. В одном из этих растворов присутствует основной ион A (активность aA) и отсутствует ион B, а во втором, наоборот. Если разности потенциалов в первом и во втором случае равны Е1 и Е2, то
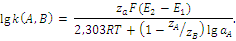
Это уравнение справедливо только при условии, если наблюдается нернстовская реакция ионоселективного электрода по отношению к основному иону A.
Во втором методе используется большее число растворов, в каждом из которых величина активности мешающего иона аB постоянна, а активность основного иона aA должна обычно меняться на несколько порядков. Далее строится кривая зависимости наблюдаемой разности потенциалов от lg aA. В точке перегиба:
 ,
,
где aA – активность иона А, при которой электрод одинаково реагирует на оба сорта ионов.
В практике потенциометрического анализа используются ионоселективные электроды с жидкостной, твердой и кристаллической мембранами.
Ионоселективные электроды с жидкостной мембраной. Обычно в качестве мембраны используют нерастворимую в воде органическую фазу, введенную в пленку или пластину с пористой или гелевой структурой (например, в пористый тефлон или поливинилхлорид), (рис. 2.2).
 |
В этой органической фазе растворен электролит М+А-, один из ионов которого, например анион А-, не может переходить в водную фазу. Если этот ион обладает способностью избирательно связывать катион М+, то изготовленная указанным способом мембрана может служить основой селективного к М+ электрода. Обычно мембрана находится в контакте с сосудом, заполненным тем раствором, который введен в пленку или пластину. Это позволяет избежать ошибок, связанных с растворением органической фазы в анализируемом растворе.
Ионоселективные электроды c твердой мембраной. Рассмотрим на примере стеклянного электрода. Состоит из стеклянного шарика (мембраны толщиной ~0,06 – 0,1 мм) состава: SiO2 – 60 – 70%; Al2O3 – 17 – 30%; M2O – 3 – 16%, где М – Na, Li), и вспомогательного электрода (2) (рис.2.3).
 |
Стекло представляет собой переохлажденную жидкость (силикат), в которой подвижные ионы Li+ и Na+ могут замещаться на H+-ионы. Ионы водорода, проникая в стекло, образуют гелекремневую кислоту, т. о. граница раздела насыщена ионами H+. Если электрод поместить в раствор с неизвестным рН, то будет происходить перенос ионов H+ между стеклом и раствором, в результате чего возникает потенциал:
 .
.
Наряду с обменом ионами водорода будет идти процесс обмена: H+ + M+ст. ↔ (здесь стрелки туда и обратно) H+ст. + M+. Этот процесс характеризуется константой обмена:
 K – большой буквой в формуле!!!!!.
K – большой буквой в формуле!!!!!.
Так как
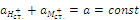 ,
,
то, выражая активность ионов металла в стекле через суммарную активность и выражая отношение активностей ионов водорода в растворе и стекле, получаем:
 .
.
Подставим данное выражение в уравнение Нернста:
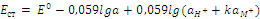 .
.
Так как  для данного сорта стекла, то
для данного сорта стекла, то
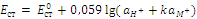 .
.
Константа обмена для стеклянного электрода имеет величину порядка 10–15–10–10, ам+ тоже мала в кислых, нейтральных и слабощелочных растворах, Поэтому поэтому можно принять, что E ст. ~ pH.
Электроды с кристаллической мембраной. В данных электродах используется кристаллическая мембрана, состоящая либо из одного химического соединения, например Ag2S, либо из однородной смеси двух или большего количества соединений, например, AgI и Ag2S.
С помощью электродов с твердой кристаллической мембраной можно проводить определение следующих ионов: F–, Cl–, Br–, I–, CN–, SCN–, S2–, Ag+, Cu2+, Pb2+, Cd2+.
Дата публикования: 2015-09-17; Прочитано: 4910 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
