 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Возникновение межфазного скачка потенциалов
|
|
Возникновение электродного потенциала связано с электрохимическим процессом, происходящим на границе раздела фаз электрод – раствор. При контакте двух фаз на границе между ними возникает разность потенциалов, которая появляется в результате частичного перехода заряженных частиц через границу раздела или адсорбции дипольных молекул или ионов на границе фаз. Упорядоченное распределение положительных и отрицательных зарядов вдоль границы контактирующих фаз не нарушает электронейтральности всей системы в целом. Однако одна из фаз может содержать избыток положительных или отрицательных зарядов, а в другой фазе соответственно имеется избыток зарядов противоположного знака. Возникает двойной электрический слой (ДЭС) и, как следствие, скачок потенциала. При контакте металла с раствором его соли в зависимости от концентрации раствора поверхность металла может заряжаться отрицательно или положительно, в зависимости от того, какой процесс шел с большей скоростью на границе «металл - раствор» до установления равновесия.
Условием равенства двух соприкасающихся фаз является равенство их химических потенциалов: μα = μβ. Если происходит обмен заряженных частиц, то условие равновесия характеризуется равенством электрохимических потенциалов: 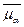 =
= 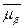 .
.
Так как химический потенциал равен: μ = μ0 + RTlna, а
электрохимический потенциал: μ = μ0 + zFE, то из условия их равенства получим:
 , ,
| (2.1) |
где zFE – работа против сил поля, которую нужно совершить, чтобы перенести заряженную частицу из объема в фазу с потенциалом Е.
Если за скачок потенциала между двумя фазами принять разность потенциалов двух фаз: Е = Еα – Еβ, то уравнение (2.1) примет вид:

Так как первый член уравнения величина постоянная для данной системы, то ее можно обозначить новой константой E0, в результате получим выражение, которое носит название уравнения Нернста:

| (2.2) |
где E – равновесный потенциал, Е0 – стандартный электродный потенциал; R – универсальная газовая постоянная; Т – температура, К; F – постоянная Фарадея; z – число участвующих в электродном процессе электронов; аоx , аred – активности окисленной и восстановленной форм ионов в растворе.
Переходя от натуральных логарифмов к десятичным и объединяя в уравнении (2.2) все постоянные величины, получим (при температуре 25°С):
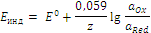
| (2.3) |
Определить абсолютное значение потенциала невозможно. Потенциал отдельного электрода может быть измерен лишь по отношению к потенциалу другого электрода – электрода сравнения. В качестве электродов сравнения чаще всего используют идеально неполяризующиеся электроды, потенциал которых можно воспроизвести многократно с достаточной точностью. Это достигается обычно при постоянстве условий протекания электродной реакции и создании чрезвычайно развитой поверхности электрода. В зависимости от природы электродной реакции выделяют несколько типов электродов.
Дата публикования: 2015-09-17; Прочитано: 715 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
