 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Электроды первого рода
|
|
К этой группе относятся:
Системы, в которых потенциалопределяющие ионы принимают непосредственное участие в электродной реакции с образованием электроактивного продукта.
1. Это металлы либо неметаллы, погруженные в раствор, содержащий его ионы. Электрод можно представить в виде схемы:
Mz+ + z e = M0, где M – металл, металлоид, газ.
Для таких электродов потенциал зависит только от активности ионов металла в растворе. Например, для медного электрода, опущенного в раствор собственной соли, значение равновесного потенциала будет определяться выражением:
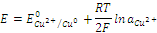
А для системы, содержащие металлоид, погруженный в раствор с анионами данного металлоида, например, для системы: Se0 + 2e = Se2–, выражением:
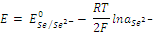
При низких концентрациях раствора активность можно заменить на концентрацию.
2. Амальгамные электроды представляют собой растворы ряда металлов (Ti, In, Zn, Ag, Au, Cd, Sn, Pb и др.) в ртути. Электродная реакция и уравнение Нернста для амальгамных электродов (на примере цинкового амальгамного электрода) имеют вид:
Zn2+ + 2e + Hg = Zn(Hg),
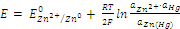 .
.
Так как активность чистой ртути равна 1, а активность металла в разбавленной амальгаме величина постоянная, уравнение Нернста при 25 °С примет вид:
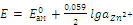 .
.
3. Газовые электроды. Представляют собой инертный металл, одновременно контактирующий с газом и раствором, содержащим одноименные с газом ионы. Наиболее известными и применяемые в аналитической практике являются:
а). Водородный электрод. Является лучшим электродом сравнения, благодаря его высокой воспроизводимости величины равновесного потенциала. Его можно использовать в большом диапазоне температур и рН раствора. Представляет собой платиновый электрод, помещенный на 2/3 в раствор серной кислоты. Через раствор под постоянным давлением пропускают газообразный водород. Если активность ионов водорода равна 1 моль/л, а газообразный водород пропускают под давлением 1 атм, то такой электрод называют стандартным водородным электродом. Для такого элемента ЭДС, с учетом того, что стандартное значение ЕН+/ЕН2 принимается равным нулю, будет равна:
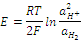
Если условия стандартные, то  и уравнение Нернста принимает вид:
и уравнение Нернста принимает вид:
 .
.
б). Кислородный электрод. Для реакции, протекающей по схеме: O2 + 2H2O + 4e = 4OH– уравнение Нернста имеет вид:
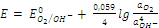 .
.
Если парциальное давление кислорода равно 1 атм, тогда:

Дата публикования: 2015-09-17; Прочитано: 1206 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
