 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Электроды второго рода
|
|
К электродам второго рода относятся металлические электроды, поверхность которых покрыта малорастворимой солью или гидратированным оксидом. Потенциалопределяющими являются ионы, которые сами не принимают участия в электродной реакции, но участвуют в химической реакции в растворе. Величины равновесных потенциалов электродов второго рода хорошо воспроизводимы, поэтому некоторые из них используются в качестве электродов сравнения. Наибольшее распространение имеют хлоридсеребряный, каломельный и металлоокисные электроды.
Каломельный электрод. Представляет собой стеклянный сосуд, на дно которого помещается очищенная ртуть таким образом, чтобы токоотвод – платиновая проволочка была полностью погружена в ртуть (рис. 2.1). На поверхность ртути наносят слой каломельной пасты (Hg2Cl2). Затем в полуэлемент заливают раствор КCl. На электроде устанавливается равновесие: Hg2Cl2 + 2e = Hg + 2Cl–. И уравнение Нернста примет вид:

В электрохимических измерениях используют каломельные электроды с содержанием KCl 0,1 моль/л, 1 моль/л и насыщенный раствор. Их потенциалы при 25 °С по водородному электроду равны соответственно: 0,3365, 0,2828 и 0,2438 В.
 |
Хлоридсеребряный электрод. Хлоридсеребряный электрод представляет серебряную проволочку, покрытую хлоридом серебра, опущенную в раствор с заданной концентрацией KCl. На электроде устанавливается равновесие: AgCl + 1e = Ag + Cl–
Уравнение Нернста имеет вид:
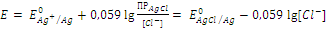 .
.
В электрохимических измерениях хлоридсеребряный электрод используется наиболее часто в качестве электрода сравнения. Потенциал хлоридсеребряного электрода при 25 °С в 1 моль/л растворе KCl равен 0,222 В, а в насыщенном растворе KCl – 0,201 В.
Металлоокисные электроды. Металлоокисные электроды состоят из металла, покрытого тонким слоем оксида данного металла. В роли анионов малорастворимых соединений выступают ионы гидроксида. Примером металлоокисных электродов являются ртутно-оксидный (OH– /HgO, Hg) и сурьмяный (OH– /Sb2O3, Sb) электроды. Металлоокисные электроды обычно используют для определения рН растворов. Область измерения рН зависит от устойчивости оксидной пленки. В табл. 2.1 приведены электродные реакции и уравнения Нернста для металлоокисных электродов.
Таблица 2.1. Электродные реакции и уравнения Нернста для металлоксидных электродов.
| Тип электрода | Электродные реакции и уравнения Нернста |
| (OH– / HgO, Hg) |
HgO + H2O + 2e = Hg + 2OH–

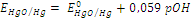
|
| (OH– / Sb2O3, Sb) |
Sb2O3 + 3H2O + 6e = 2Sb + 6OH–
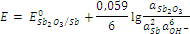
|
Следует отметить, что для рассмотренных металлооксидных типов электродов (OH–/HgO, Hg; OH– / Sb2O3, Sb) характерно медленное установление равновесного потенциала (до двух суток). Преимущественно они используются как вспомогательные электроды при исследованиях в щелочных растворах.
Дата публикования: 2015-09-17; Прочитано: 2542 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
