 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Расчет ячеечного реактора
|
|
3.1.1 ПОСТАНОВКА ЗАДАЧИ
Химические реакции проводятся в основном в аппаратах, называемых химическими реакторами. В зависимости от теплового режима, в котором протекает реакция, ее можно проводить либо в трубчатых реакторах (неизотермические режимы), либо в аппаратах с мешалкой (реакторы идеального смешения чаще всего применяются для изотермических процессов). Многие химические процессы с целью повышения степени превращения проводят в нескольких последовательно соединенных реакторах идеального смешения.
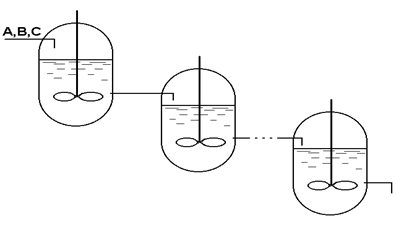
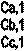 | |||||||||
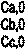 | |||||||||
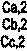 | |||||||||
 | |||||||||
 | |||||||||
Рис.3.1 – Схема ячеечного реактора.
Структура потоков в аппаратах подобного типа близка к ячеечной модели, если предположить, что взаимодействия между реагирующими веществами при перетекании их из реактора в реактор не происходит. Таким образом, концентрация Сi,j любого компонента в смеси, поступающей в последующий реактор (рис.3.1)равна концентрации его в предыдущем реакторе Ci-1,j.
3.1.2 ВЫВОД МАТЕМАТИЧЕСКОГО ОПИСАНИЯ
Математическое описание для нестационарных условий проведения процесса имеет вид:
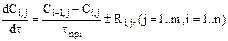 (1)
(1)
где Ri,j – суммарная скорость по j-му компоненту в i-м реакторе;
n – количество реакторов в каскаде;
m – количество реагирующих веществ.
Допустим, в каскаде реакторов в изотермических условиях протекает химическая реакция:
 А к1 В к2 С
А к1 В к2 С
Необходимо для установившегося режима определить количество реакторов в каскаде, при котором выход продукта В был бы максимальным, а выход побочного продукта С возможно меньшим.
Для данного химического процесса в стационарных условиях работы математическое описание будет иметь вид:
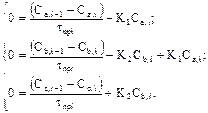 (2)
(2)
Преобразуем систему (2), разделив дроби почленно:
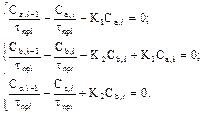 (3)
(3)
Решаем эту систему относительно концентраций реагирующих веществ:
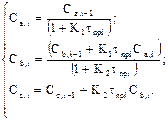 (4)
(4)
Таким образом может быть вычислена концентрация реагирующих веществ вначале в первом реакторе, а затем во втором и т.д. Сравнивая концентрацию компонента В в очередном реакторе с концентрацией в предыдущем можно найти такое количество реакторов в каскаде, при котором выход продукта В будет наибольшим. Варьируя величиной констант K1 и K2, а также временем пребывания (τпр i) в реакторах каскада, можно провести исследования работы ячеечной модели и найти наилучший вариант работы.
Систему линейных уравнений (3) можно решить методом Гаусса, но для этого надо привести её к виду:
A · X = B, (5)
где А – двумерный массив коэффициентов при неизвестных;
Х – одномерный массив текущих концентраций;
В – одномерный массив свободных членов.
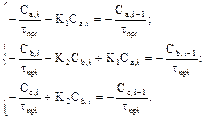 (6)
(6)
Сгруппируем слагаемые, содержащие одинаковые концентрации и получим:
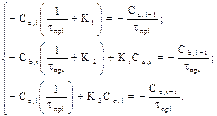 (7)
(7)
Представим полученную систему линейных уравнений в виде табл. 3.1.
Таблица 3.1 – Таблица массивов
| Массив А | Массив В | Массив Х | ||
| Ca | Cb | Cc | ||
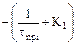
| 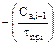
| Ca,i | ||
| K1 | 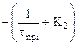
| 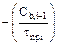
| Cb,i | |
| K2 | 
| 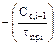
| Cc,i |
3.1.3 УСЛОВИЯ ОДНОЗНАЧНОСТИ
Для „привязки” математического описания к реальному объекту необходимо определить значения многих переменных, в соответствии с конструкцией конкретного аппарата и условиями его работы. Для этих целей используют условия однозначности (УО), состоящие из:
1. Начальные условия характеризуют значения технологических параметров в начальный момент времени (при τ=0) в любой точке объекта. При этом значение технологических параметров зависит от способа запуска или останова объекта. Так, например, если перед началом работы ячеечный реактор был заполнен реакционной смесью и в момент времени τ=0 созданы условия для протекания реакции (например, температурные условия), то распределение концентраций будет следующим:
Сa(τ=0, х=0) = 100 % Сa(τ=0, х>0) = 100 %
Cb(τ=0, х=0) = 0 % Cb(τ=0, х>0) = 0 %
Cc(τ=0, х=0) = 0 % Cc(τ=0, х>0) = 0 %
Если же вначале аппарат был пуст, а в момент времени τ=0 в него подали реакционную смесь и создали условия для протекания реакции, то распределение концентраций будет следующим:
Сa(τ=0, х=0) = 100 % Сa(τ=0, х>0) = 0 %
Cb(τ=0, х=0) = 0 % Cb(τ=0, х>0) = 0 %
Cc(τ=0, х=0) = 0 % Cc(τ=0, х>0) = 0 %
2. Граничные условия первого рода (ГУ-I) характеризуют значение технологических параметров на границах объекта в любой момент времени:
Сa(τ, х=0) = 100 % Сa(τ, х=L) = 0 %
Cb(τ, х=0) = 0 % Cb(τ, х=L) = 0 %
Cc(τ, х=0) = 0 % Cc(τ, х=L) = 0 %
где (х=L) определяет координату выхода из аппарата.
3. Граничные условия второго рода (ГУ-II) определяют значения плотностей потоков масс или энергии на границах объекта, характеризующихся соответственно законами Фика и Фурье:
qD = -D 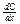 , qλ = -
, qλ = -  ,
,
где D – коэффициент диффузии, м/с;
λ – коэффициент теплопроводности, м2 ºС/м.
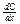 ,
, 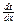 – соответственно градиенты концентраций и температур.
– соответственно градиенты концентраций и температур.
Для рассматриваемого процесса в связи с отсутствием градиента ГУ-II не имеют смысла.
4. Граничные условия третьего рода (ГУ-III) определяют равенство плотностей потоков масс или энергии на границах раздела двух разнородных фаз (см. рис. 3.2).
Как известно, на границе соприкосновения фаз возникает псевдонеподвижный слой теплоносителя или газа в абсорбере (приведенный слой). Внутри этого слоя тепло или масса передаются на молекулярном уровне (теплопроводностью или диффузией):
qD = -D 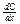 , qλ = -
, qλ = - 
В движущемся слое перенос тепла или массы происходит на молярном уровне по закону Ньютона (плотность потока пропорциональна движущей силе):
qβ = β(С-С*), qα = α(t-tпл)
При равенстве потоков можно записать:
D 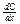 = β(С- С*),
= β(С- С*),  = α(t- tпл),
= α(t- tпл),
где С* и tпл –значение концентрации и температуры в приведенной пленке.
Граничные условия третьего рода позволяют получить при формальном делении правой части равенства на левую безразмерное соотношение (число Нуссельта), показывающее соотношение интенсивностей конвективного и кондуктивного переноса тепла. Следовательно, число Нуссельта также может быть отнесено к граничным условиям третьего рода. Для данного процесса в связи с отсутствием процесса массопереноса ГУ-III не имеют смысла.
 |
Рис 3.2. – Иллюстрация к граничным условиям третьего рода (а – теплообменные процессы; б – массообменные процессы).
5. Граничные условия четвертого рода (ГУ-IV) характеризуются равенством плотностей потоков массы или энергии на границе раздела двух одинаковых фаз (газ-газ, жидкость-жидкость, твердое-твердое), передаваемых на молекулярном уровне. Форма записи ГУ-IV следующая:
D1 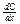 1 = D2
1 = D2 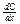 2, λ1 dt1 /dx = λ2 dt2 /dx.
2, λ1 dt1 /dx = λ2 dt2 /dx.
Для рассматриваемого процесса ГУ-IV не имеют смысла.
6. Геометрические условия задают размеры аппарата и отдельных его элементов (диаметр сечения, по которому движется поток технологического вещества, длина пути, размеры трубок, насадки и т.д. и т.п.).
7. Теплофизические условия определяют свойства технологических веществ: плотности (кг/м3), теплоемкости (Дж/кг град), теплопроводности (Дж/(м2 град/м)), коэффициенты диффузии (м2/с) и т.д.
8. Кинетические условия определяют линейные скорости движения технологических веществ, массовые и объемные скорости, коэффициенты скоростей процессов (коэффициенты тепло- и массообмена, коэффициенты скоростей химических реакций и т.д.).
3.1.4 ВЫБОР МЕТОДА РЕАЛИЗАЦИИ
В зависимости от конкретных требований к математической модели, условий проведения процесса и ряда других требований реализация математического описания процесса может осуществляться по различным алгоритмам. Так для нестационарного процесса в изотермическом режиме удобнее всего использовать метод Рунге-Кутта для решения системы дифференциальных уравнений. В случае неизотермических условий проведения процесса, который чаще всего проводят в аппаратах со структурой потока МИВ и описывается системой дифференциальных уравнений в частных производных, целесообразно использовать метод представления одной из производных в дискретном виде (дискретизация пространства или сканирование по времени). Тогда получится система из N∙K дифференциальных уравнений, которую удобно решить с помощью метода RK-4. Возможно одновременное проведение и дискретизации пространства и сканирования по времени. В этом случае получим систему из M∙N∙K алгебраических уравнений, которую можно решить методом Гаусса и получить распределение концентраций и температур в пространстве и во времени. Для данной задачи при простой кинетической схеме протекания процесса в изотермических условиях в ячеечной модели есть возможность аналитического решения, что в значительной мере упрощает алгоритм реализации.
3.1.5 БЛОК – СХЕМА РЕАЛИЗАЦИИ

3.1.6 ИДЕНТИФИКАЦИЯ ПЕРЕМЕННЫХ
В связи с некоторыми особенностями представления переменных, векторов и массивов на языке PASCAL, невозможностью использования греческих букв и т.д. мы вынуждены прибегать к использованию специфических представлений переменных, а, следовательно, и таблицы идентификации.
Таблица 3.2 – Идентификация переменных
| № п/п | Перемен. в прогр. | Переменная в мат.опис. | Смысл и размерность переменной | Значение |
| Сi,1 Сi,2 Сi,3 Tau К1 К2 dK1 dK2 dTau | Са Сb Сc τ К1 К2 ΔK1 ΔK2 Δτ | Концентрация компонента А в i-той яч.,% Концентрация компонента B в i-той яч.,% Концентрация компонента C в i-той яч.,% Время пребывания в i-той яч.,с Константа скорости,1/с Константа скорости,1/с Интервал варьирования Интервал варьирования Интервал варьирования | при i=0 Са =100 при i=0 Сb =0 при i=0 Сc =0 0.5 0.15 0.25 0.075 0.125 0.5 |
3.1.7 ВАРИАНТЫ ЗАДАНИЙ
Таблица 3.3 – Варианты заданий
Дата публикования: 2015-09-17; Прочитано: 493 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
