 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примеры решения задач. Пример 1. Удельная электропроводность 0,01 н раствора хлорида калия равна 0,001423 Ом−.см−
|
|
Пример 1. Удельная электропроводность 0,01 н раствора хлорида калия равна 0,001423 Ом−.см−. Рассчитать эквивалентную электропроводность раствора.
Дано:
С(KCl) = 0,01 моль/л
 ϰ =0,001423 Ом−.см−
l −? ϰ =0,001423 Ом−.см−
l −?
| Решение: эквивалентную электропроводность вычисляем по формуле:
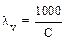 ϰ = ϰ = 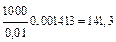 см2/Ом.моль
Ответ: 141,3 см2/ом.моль. см2/Ом.моль
Ответ: 141,3 см2/ом.моль.
|
Пример 2. Удельная электропроводность 0,5 н раствора одноосновной слабой кислоты при 25оС равна 9.10−4 Ом−.см−. Эквивалентная электропроводность при бесконечном разведении lо= 345 см2/Ом.моль. Вычис-лить степень и константу диссоциации кислоты, рН раствора.
Дано:
С(НА) = 0,5 моль/л
ϰ =9.10−4 Ом−.см−
 lо= 345 см2/Ом.моль
рН −?
a −?
K −? lо= 345 см2/Ом.моль
рН −?
a −?
K −?
| Решение: 1) рассчитываем эквивалентную электропроводность при данном разведении:
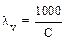 ϰ = ϰ = 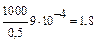 см2/Ом.моль
2) используя соотношение Аррениуса, вычисляем степень диссоциации слабой кислоты: см2/Ом.моль
2) используя соотношение Аррениуса, вычисляем степень диссоциации слабой кислоты:
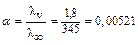
|
3) вычисляем константу диссоциации кислоты:
K= a2.C= (0,00521)2.0,5 = 1,36.10−5
4) рассчитываем рН раствора: рН = −lg[H+] = −lg(aC) = −lg(0,00521.0,5) = 2,58
Ответ: рН = 2,58; a= 5,21.10−3; K= 1,36.10−5.
Вопросы и задачи для самоподготовки
1. Что представляет удельная электропроводность растворов? Привести фор-мулу, дать определение, указать размерность. Что она характеризует?
2. Что характеризует эквивалентная электропроводность, какова ее взаимосвязь с удельной электропроводностью?
3. Как и почему изменяются удельная и эквивалентная электропроводности растворов слабых и сильных электролитов а) при изменении температуры; б) при разбавлении растворов?
4. Взаимовязь эквивалентной электропроводности растворов со степенью диссоциации электролита. Физический смысл отношения Аррениуса для
слабых и сильных электролитов.
5. Определение, математическое выражение и физический смысл закона Кольрауша.
6. Определение и физический смысл понятия “ионная электропроводность” (или “подвижность ионов”). Формула и размерность этой величины.
7. Что такое абсолютная скорость движения ионов? Дать определение и указать размерность этой величины?
8. Какие факторы и каким образом влияют на подвижность ионов в электрическом поле?
9. Почему протон и гидроксил-ионы в электрическом поле из всех ионов имеют наибольшую абсолютную скорость движения в воде? Объяснить, привести схему движения.
10. Что такое кондуктометрия и кондуктометрические методы анализа? Какие виды кондуктометрического анализа различают?
11. Каким образом работает мост Кольрауша? Как с его помощью определить сопротивление раствора?
12. Почему и каким образом при кондуктометрических измерениях определяют “константу сосуда”?
13. Как определить степень и константу диссоциации слабого электролита кондуктометрическим методом?
14. При измерении с помощью стандартных электродов (площадь 1 см2, расстоя-ние между ними 1 см) сопротивление 0,05 М раствора уксусной кислоты оказалось равным 3333 Ом. Определить степень и константу диссоциации уксусной кислоты, если ее предельная эквивалентная электропроводность составляет 385,6 см2/Ом . моль. Ответ: 1,55%; 1,23.10−5
15. Определить удельную электропроводность раствора уксусной кислоты с концентрацией 0,16 моль/л. K(CH3COOH) = 1,81.10-5, l¥(СН3СОО-) = 35,8 см2/Ом . моль, l¥(H+) = 349,8 см2/Ом . моль. Ответ: 6,56.10−5 Ом-1. см-1
16. Рассчитать степень и константу диссоциации одноосновной слабой кислоты, рН раствора, если известно, что удельная электропроводность раствора составляет 9.10-4 Ом-1. см-1, молярная концентрация эквивалента 0,5 моль/л, l¥(НА) = 345 см2/Ом . моль. Ответ: рН = 2,585, a = 0,52%
17. Удельная электропроводность 0,01 уксусной кислоты при 25оС равна 1,56.10−4 Ом−.см−. Эквивалентная электропроводность при бесконечном разведении равна 390,7 см2/Ом.моль. Вычислите рН раствора. Ответ: 3,40.
18. Кондуктометрическое титрование. Как оно проводится и для чего исполь-зуется? Как характер кондуктограммы отражает природу электролитов?
19. Можно ли использовать кондуктометрию для установления качества дистиллированной воды и растворимости трудно растворимых электролитов? Ответ обосновать.
20. Почему ткани организма проводят электрический ток? Какой тип проводимости характерен для них?
21. Каким образом используется в клинике способность тканей организма к проведению электрического тока (катодная и анодная гальванизация, ионофорез, диатермия, УВЧ-терапия).
21. Дать определение электродного потенциала. Записать уравнение электрод-ного потенциала Нернста. Пояснить все значения.
22. Что такое стандартный или нормальный электродный потенциал?
23. Нормальный водородный электрод. Как возникает его заряд, каков знак заряда, какова его величина и для чего он используется?
24. В каком случае и почему возникает диффузионный потенциал? Отчего зависит его величина?
25. Что такое мембранный потенциал, как он возникает?
26. Дать определение окислительно-восстановительного (редокс-) потенциала. Почему и как он возникает, отчего зависит его величина?
27. Что такое ряд напряжений редокс-систем? Как зависит направление реакций от редокс-потенциалов участвующих в них веществ?
28. Гальванический элемент: его устройство и работа на примере элемента Якоби - Даниеля. Почему при его работе происходит постоянный перенос электро-нов во внешней цепи? Записать электрохимическую схему гальванического элемента. Показать скачки потенциалов, возникающих в гальваническом элементе. Что такое ЭДС гальванического элемента, чему она равна?
29. Классификация гальванических элементов: дать объяснения, привести примеры.
30. Электроды I и II родов. Что общего у них в механизме возникновения потенциала? Дать пояснения, привести примеры.
31. В чем сущность компенсационного метода измерения ЭДС гальванических элементов? Дать объяснения, привести схему установки, изложить порядок работы и расчетов.
32. В чем сущность потенциометрического метода измерения рН растворов? Какие типы электродов должны использоваться в этом методе, каким требованиям они должны удовлетворять?
33. Устройство, принцип работы, назначение и схематичное обозначение и применение стеклянного электрода.
34. Показать на электрохимической схеме какие скачки потенциалов возникают в цепи из стеклянного электрода и электрода сравнения при потенциомет-рическом определении рН растворв.
35. Что представляют собой рН-метры? Что непосредственно измеряет и регистрирующий прибор рН-метра?
36. Какие электрические потенциалы ионной природы возникают в организме? Какое значение они имеют?
37. Где и почему возникают окислительно-восстановительные потенциалы в организме? Какое значение они имеют?
Дата публикования: 2015-09-18; Прочитано: 5202 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
