 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Основи теоретичного матеріалу. Процеси перетворення хімічної енергії в електричну і навпаки називають електрохімічними
|
|
Процеси перетворення хімічної енергії в електричну і навпаки називають електрохімічними. При зануренні металу у водний розчин його солі частина його йонів переходить в розчин, а поверхня заряджається негативно. На межі «метал-розчин» виникає подвійний електричний шар з відповідною різницею потенціалів, яка називається електродним по потенціалом φ. Величина потенціалу електроду обчислюється за рівнянням Нернста:
φ = φ0 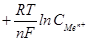 .
.
Для стандартних умов (T = 298 K, p = 105 Па)
φ = φ0  .
.
За своєю хімічною активністю метали розташовані в ряд, який називається рядом стандартних електродних потенціалів. Кількісною характеристикою їх відновних властивостей є стандартний електродний потенціал φ0.
Найчастіше ці процеси відбуваються в системах, де існує контакт металічної поверхні з розчином електроліту. Ряд напруг металів характеризує поведінку металів і їх солей тільки у водних розчинах, оскільки потенціали враховують особливості взаємодії того чи іншого йону металу з молекулами розчинника. Ряд починається з літію, що пов’язано із винятково високою енергією процесу гідратації йонів літію в порівнянні із йонами інших лужних металів.
1) Чим більш негативний електродний потенціал металу, тим більші його відновні властивості.
2) Кожний метал витісняє (відновлює) із розчинів солей ті метали, які розміщені в ряду напруг металів після нього. Винятком є лише лужні і лужноземельні метали, які не будуть відновлювати йони інших металів із розчинів їх солей. Це пов'язано з тим, що в даних випадках з більшою швидкістю протікають реакції взаємодії металів з водою.
Система або пристрій для безпосереднього перетворення енергії хімічної реакції в електричну називається гальванічним елементом.
Прикладом такої системи є гальванічний елемент Даніеля – Якобі (рис. 4):
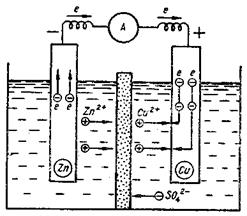
Рисунок 4 – Гальванічний елемент Даніеля – Якобі
Гальванічний елемент Даніеля - Якобі складається із цинкового і мідного електродів, занурених відповідно у розчини сульфатів цинку і купруму, які розділені пористою мембраною.
На цинковому електроді відбувається розчинення цинку з перетворенням його атомів на йони, а вивільнені електрони по провіднику переходять на мідний електрод, де відбувається розрядження катіонів Купруму, що супроводжується виділенням металічної міді (процес відновлення).
Під час роботи цинк окиснюється
Zn - 2ē = Zn2+ (окиснення),
а йони купруму відновлюються
Cu2+ + 2е = Cu (відновлення).
Сумарний процес:
Zn + Cu2+= Cu + Zn2+
Електрод, на якому відбувається окиснення, називається анодом (Zn); він заряджений негативно «–». Електрод, на якому відбувається відновлення – катодом (Cu); він заряджений позитивно «+».
Схему гальванічного елемента записують таким чином:
(–) Zn ׀ Zn2+ ׀׀ Cu ׀ +2 Cu (+),
де зліва анод, що показаний як (—) Zn ׀ Zn2+, а справа катод Cu ׀ +2 Cu (+), які розділені мембраною – ׀׀.
Максимальне значення напруги гальванічного елемента, що відповідає перебігу реакції в прямому і зворотному напрямках називається електрорушійною силою гальванічного елемента (ЕРС). Вона дорівнює різниці потенціалів між його електродами. За стандартних умов для елемента Даніеля – Якобі ЕРС зазначена в додатку Е.
ЕРС = φ°кат. - φ°ан. = +0,34 –(–0,76) = + 1,1 В.
Акумулятори — це прилади для накопичування хімічної енергії, яка в разі потреби може перетворюватися в електричну енергію. Вони здатні перетворювати нагромаджену хімічну енергію на електричну (при розрядженні), а електричну – на хімічну (при зарядженні).
Найбільше поширення і практичне застосування мають свинцевий і лужні акумулятори.
Свинцевий або кислотний акумулятор складається з двох електродів, занурених у розчин сульфатної кислоти
(22-28%-й). Один електрод (пресований PbO2) є катодом, а другий (решітчаста пластина металічного свинцю) – анодом акумулятора. Схему свинцевого акумулятора можна записати так:
(–) Pb ׀ H+, SO42- ׀ PbO2 (+)
Для підготовки акумулятора до роботи проводять процес зарядження, коли через акумулятор пропускають постійний електричний струм і на електродах відбуваються електрохімічні процеси (рис. 5, а),
(-): PbSO4 + 2ē → Pb + SO42 -.
(+): PbSO4 + 2H2O — 2ē → PbO2 + 4H+ + SO42-,
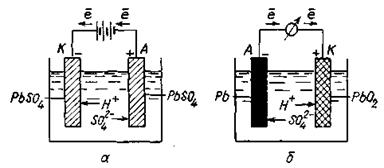
Рисунок 5 - Схема роботи свинцевого акумулятора
Під час розряджання акумулятора на електродах відбуваються протилежні процеси (рис. 5, б):
(–): Pb + SO42- – 2ē → PbSO4 φ° = -0,36 В.
(+): PbO2 + 4H+ + SO42- + 2ē → PbSO4 + 2H2O φ° = +1,86В.
EPC акумулятора Е° = φ°кат. - φ°ан. = +1,68 - (-0,36) = + 2,04 В.
Загальне рівняння реакції роботи свинцевого акумулятора має вигляд:
розрядження
Pb + 2H2SO4 + PbO2 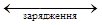 PbSO4 + 2PbSO4+2H2O.
PbSO4 + 2PbSO4+2H2O.
До лужних акумуляторів належать залізно-нікелевий, кадмієвий і срібно-цинковий акумулятори. Електролітом для них є 20 - 30 %-й розчин лугу KOH і LiOH. Зарядження і розрядження лужного залізо-нікелевого акумулятора відбувається за схемою:
розрядження
Fe + 2Ni(OH)3 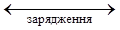 Fe(OH)2 + 2Ni(OH)2.
Fe(OH)2 + 2Ni(OH)2.
Електроліз – це сукупність окисно-відновних електрохімічних процесів, які відбуваються під впливом електричного струму на електродах, занурених у розчин або розплав електроліту. Важливу роль в процесі електролізу відіграє матеріал, з якого виготовлено електроди, особливо анод, який може окиснюватись. У зв'язку з цим розрізняють електроліз з інертними і активними анодами. Як інертні аноди використовують графіт, вугілля, платину, а як активні - будь-який метал, стійкий на повітрі і у вологому повітрі
Дата публикования: 2015-09-18; Прочитано: 332 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
